التمنيع.
من ويكيبيديا، الموسوعة الحرة

الدكتور شرايبر من سان أوغسطين يعطي تطعيمالتيفوئيد في مدرسة في المناطق الريفية من سان أوغسطين بولاية تكساس. نقل من مكتب معلومات الحرب، الولايات المتحدة عام 1944

طفل يجرى تلقيحه ضد شلل الأطفال
التمنيع أو التحصين (بالإنجليزية: Immunization) هي العملية التي من خلالها يصبح نظام الفرد المناعي محصنة ضد عامل ما يعرف باسم المستمنع (بالإنجليزية: Immunogen).
عندما يتعرض هذا النظام لجزيئات غريبة على الجسم (ليست من ذات الجسم)، سوف يقوم بتنسيق استجابة مناعية وأيضاً بتطوير القدرة على الاستجابة بسرعة إلى تهديد مماثل مستقبلس من خلال آلية ذاكرة مناعية (بالإنجليزية: Immunological Memory). هذه وظيفة من وظائف الجهاز المناعي التكيفي (بالإنجليزية: Adaptive Immune System). ولذلك، من خلال تعريض الحيوان لمستمنع بطريقة مسيطر عليها، يمكن تهيئته لتعلم حماية نفسه: وهذا ما يسمى تمنيع نشط.
أهم عنصر من عناصر نظام المناعة التي يمكن أن تتحسن عن طريق التمنيع هي الخلايا البائية (بالإنجليزية: B Cells) (والأجسام المضادة التي تنتجها) والخلايا التائية (بالإنجليزية: T Cells). ذاكرة الخلايا البائية وذاكرة الخلايا التائية هي المسؤولة عن الاستجابة السريعة لمواجهة ثانية مع الجزيء الأجنبي. التحصين السلبي هو عندما يتم إدخال هذه العناصر مباشرة في الجسم بدلاً من أن يقوم الجسم في حد ذاته بإنتج هذه العناصر.
ويتم التمنيع من خلال تقنيات مختلفة، أكثرها شيوعاً التطعيم (بالإنجليزية: vaccination). لقاحات ضد الكائنات الحية الدقيقة التي تسبب الأمراض يمكن أن تحضر نظام المناعة في الجسم مما يساعد في مكافحة أو منع حدوث عدوى. الحقيقة أن الطفرات يمكنه أن تجعل الخلايا السرطانية تقوم بإنتاج بروتينات أو الجزيئات غير معروفة للجسم يشكل الأساس النظري للقاحات السرطان العلاجية (بالإنجليزية: therapeutic cancer vaccines).
ويمكن استخدام جزيئات أخرى للتمنيع كذلك، على سبيل المثال في لقاحات تجريبية ضد النيكوتين (NicVAX) أو هرمون جريلين (في التجارب لإنشاء لقاح السمنة).
وقد تم اعتبار التمنيع/التطعيم كواحد من عشرة من "كبرى إنجازات الصحة العامة في القرن 20".
تمنيع نشط
تمنيع نشط ينطوي على إدخال جزيء أجنبي في الجسم، وهو ما يجعل الجسم في حد ذاته يقوم بتوليد مناعة ضد هذا الهدف. هذه الحصانة تأتي من خلايا تي وخلايا باء مع الأجسام المضادة.
تمنيع سلبي
في التمنيع السلبي يتم نقل عناصر في الجهاز المناعي مصنعة مسبقا للشخص بحيث لا يكون على الجسم أن يقوم بإنتاج هذه العناصر بنفسه. حاليا، يمكن استخدام الأجسام المضادة للتمنيع السلبي. هذا الأسلوب من التمنيع يبدأ العمل بشكل سريع جدا، ولكنه لا يدوم طويلاً، وذلك لأن من الطبيعي أن يتم تفتيت الأجسام المضادة، وإذا لم يكن هناك خلايا باء لإنتاج المزيد من الأجسام المضادة، فإنها سوف تختفي.
انظر أيضاً
التطعيم
---------------------------
اللقاح.
من ويكيبيديا، الموسوعة الحرة

جوناس سولك في جامعة بيتسبرغ عام 1955 يحمل قارورتين لعينات مزروعةللقاح شلل الاطفال..
اللقاح (بالإنجليزية: Vaccine) هو مستحضر بيولوجي، يقدم المناعة الفاعلة المكتسبة تجاه مرض معين. يحوي اللقاح بشكل نموذجي على وسيط يشبه العضوية الدقيقة المسببة للمرض، وغالباً يصنع من الأشكال المضعفة أو المقتولة للجرثوم، أو من سمومه، أو أحد بروتيناته السطحية. يحرض هذا الوسيط الجهاز المناعي للجسم ليتعرف على هذا الجرثوم كمهدد له ويدمره، و يبقي لديه نسخة منه كي يستطيع الجهاز المناعي التعرف عليه ويحطمه بسهولة إذا هاجمه أي من هذه العضويات مرة أخرى. عملية تقديم اللقاح تدعى بعملية التلقيح. تمت دراسة فعالية التلقيح و التحقق منها بشكل جيد، على سبيل المثال لقاح الانفلونزا،[1] لقاح الفيروس الحليمومي البشري،[2] لقاح الجدري.يعد التلقيح الطريقة الأولى الفعالة للوقاية من الأمراض المعدية. المناعة واسعة الانتشار المأخوذة من اللقاحات مسؤولة بشكل كبير عن الاستئصال العالمي لمرض الجدري، والحد من أمراض أخرى كشلل الأطفال، والحصبة، والكزاز في معظم مناطق العالم. بينت منظمة الصحة العالمية أن اللقاحات المرخصة حالياً متاحة للوقاية أو للمساهمة في الوقاية وضبط 25 مرض معد يمكن أن تكون اللقاحات وقائية (مثال: تقي أو تحسن آثار مرض مستقبلي عبر عامل ممرض طبيعي أو بري)، أو علاجية (مثال: هناك لقاحات وصفت ضد السرطانات أيضاً، انظر اللقاحات ضد السرطان). مصطلح اللقاح و التلقيح مشتق من Variolaevaccinae (جدري البقر)، أوجد إدوارد جينر الاسم ليدل على جدري البقر. استخدمه في عام 1798 تحت عنوانه العريض "التحقيق في اللقاح الجدري المعروف باسم لقاح جدري البقر"، و الذي وصف فيه التأثير الوقائي لهذا اللقاح ضد الجدري. في عام 1881، لتكريم جينر، اقترح العالم لويس باستور أن المصطلح يجب أن نوسعه ليغطي كل لقاح جديد يُكتشف لاحقاً.
الفعالية

لقاح الحصبة الذي ابتكره Maurice Hilleman يقدر بانه منع 1 مليون وفاة من الحصبة سنويا
تاريخياً، كانت اللقاحات هي الوسائل الأكثر فعالية لمحاربة واستئصال الأمراض المعدية. و مع ذلك، كان هناك تقييد لهذه الفعالية. كانت تفشل الوقاية في بعض الأوقات على الرغم من ان المضيف يقوم بانتاج اجسام مضادة بسبب عدم استجابة الجهاز المناعي للمضيف بشكل كاف، أو عدم استجابته إطلاقاً. قلة الاستجابة هذه كانت تنتج بشكل شائع عن عوامل سريرية، كداء السكري، استعمال الستيروئيدات، الإيدز، العمر. على أية حال ممكن أن تفشل الوقاية أيضاً بسبب عوامل وراثية إذا كان الجهاز المناعي للمضيف لا يحوي على سلالات من الخلايا البائية التي تستطيع توليد الاجسام المضادة المناسبة للبدء بالفعالية، و الارتباط بمولدات الضد المرتبطة بالعامل الممرض. حتى لو شكل المضيف اجساما مضادة ممكن أن تكون الوقاية غير كافية، ممكن أن تتطور المناعة بشكل بطيء جداً، بحيث لا تستطيع الاجسام المضادة تعطيل العامل الممرض بشكل كامل، و من الممكن أن يكون هناك سلالات عديدة من العامل الممرض، لا تكون كلها حساسة بشكل متساوي للتفاعل المناعي. على أية حال، حتى المناعة الجزئية، المتأخرة أو الضعيفة، كالتي تنتج عن المناعة المتصالبة تجاه سلالة غير السلالة المستهدفة، يمكن أن تخفف التهاباً متسببة بمعدل وفيات أقل، و إمراضية أقل، و شفاء أسرع. المساعدات تستخدم بشكل شائع لزيادة الاستجابة المناعية، و بشكل خاص للأعمار الأكبر من الناس (50 إلى 75 عام أو أكثر ) ، و الذين تكون استجابتهم المناعية تجاه لقاح بسيط قد أضعفت.
فعالية أو أداء اللقاح تعتمد على عدد من العوامل:
المرض نفسه (يكون أداء اللقاح في بعض الأمراض أكثر من غيرها).
سلالة اللقاح (بعض اللقاحات تكون نوعية لسلالات معينة من المرض، أو على الأقل أكثر فعالية تجاه هذه السلالات ).
فيما إذا كان جدول اللقاح ملاحظ بصورة صحيحة.
الاستجابة الغريبة للقاحات (بعض الأشخاص يبدون عدم استجابة لبعض اللقاحات، أي أنهم لا يشكلون أضداد حتى بعد تلقيحهم بشكل صحيح ).
عوامل متنوعة كالعرق، و العمر، و الاستعداد الوراثي.
إذا ظهر لدى الشخص الذي أخذ اللقاح نفس المرض الذي لقح ضده، يميل المرض أن يكون أقل قوة مقارنة بمن لم يأخذ اللقاح. فيما يلي اعتبارات هامة حول فعالية برنامج اللقاح :[الاقتباس الضروري]*
التصميم الحذر لتوقع تأثير حملة التلقيح على وبائية المرض على المدى المتوسط الى البعيد .
المراقبة المستمرة للأمراض ذات الصلة، بعد تقديم اللقاح الجديد.
الحفاظ على معدلات تمنيع عالية، حتى عندما يصبح المرض نادراً.
في عام 1958، كان هناك حالة763،094 من الحصبة في الولايات المتحدة الأمريكية، تسببت بوفاة 552 شخص بعد تقديم لقاح جديد تضاءل عدد الحالات لأقل من 150 حالة في السنة (بمتوسط 56 حالة) في أوائل ال 2008 كان هناك 64 حالة محتملة من الحصبة . 54 حالة منها كانت مستوردة من بلد آخر، على الرغم من أن 13 منها حدثت في الحقيقة خارج الولايات المتحدة ، 63 من ال 64 فرد إما لم يلقحوا لقاح الحصبة، أو هم غير متأكدين فيما إذا أخذوا هذا اللقاح.
التأثيرات الضارة
اللقاحات المعطاة في الطفولة غالباً آمنة إن وجدت لها تأثيرا جانبية فهي ضئيلة بشكل عام معدل التأثيرات الضارة يعتمد على اللقاح بعض التأثيرات الضارة المحتملة تتضمن: الحرارة، الألم حول مكان الحقن، و الآلام العضلية بالإضافة إلى ذلك، قد يكون بعض الأفراد لديهم حساسية من مكونات اللقاح. ونادرا ما يرتبط لقاح MMR مع المضبوطات الحموية.
الآثار الجانبية الحادة نادرة للغاية. ونادرا ما يرتبط لقاح الحماق مع مضاعفات في الأفراد الذين لديهم نقص مناعي واللقاحات الفيروسي العجلي يرتبط بشكل معتدل مع الانغلاف.
الأنواع

اللقاح
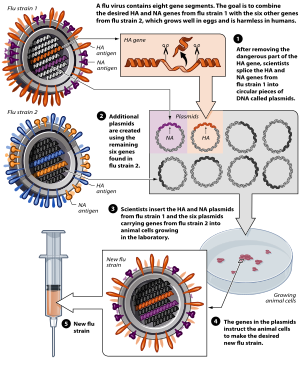
إنتاج لقاح إنفلونزا الطيور باستخدام التقنيات الوراثية.
اللقاحات هي عضيات ميتة أو مضعفة، أو منتجات منقاة مشتقة منها. هناك أنواع عديدة من اللقاحات قيد الاستخدام هذا يمثل الطرق العديدة المستخدمة لمحاولة التقليل من خطر المرض، أثناء الاحتفاظ بالقدرة على تحريض الاستجابة المناعية المفيدة.
الخامل
اللقاحات المضعفة (رابط المقالة كاملة) بعض اللقاحات تحوي عضيات دقيقة مضعفة، كانت قوية سابقاً، لكنها حطمت بالمواد الكيميائية، أو الحرارة، أو الإشعاعات، أو المضادات الحيوية. مثل الانفلونزا، الكوليرا، الطاعون الدبلي ،شلل الأطفال، التهاب الكبد A، داء الكلب .
الموهن
اللقاحات الموهنة (رابط المقالة كاملة) بعض اللقاحات تحوي عضويات دقيقة حية موهنة. العديد منها فيروسات نشطة تمت زراعتها بشروط تعطل خصائصها السمية، أو تستخدم عضيات أكثر صلة و أقل خطراً لتشكيل استجابة مناعية واسعة . على الرغم من أن معظم اللقاحات المضعفة فيروسية، لبعضها طبيعة بكتيرية. أمثلة عن الأمراض الفيروسية: الحمى الصفراء، الحصبة، الحصبة الألمانية، والنكاف. و الأمراض البكتيرية، التيفوئيد. لقاح المفطورات السلية الحي و الذي طوره (كالمت و غورين) ليس مصنوعاً من سلالات معدية، و لكنه يحوي سلاسل معدلة الفوعة تدعى BCG تستخدم لاستخراج استجابة مناعية للقاح. اللقاح المضعف الحي الذي يحوي سلاسل اليرينية الطاعونية استخدم للتمنيع من الطاعون. اللقاحات المضعفة لها عدة مزايا و عدة مساوئ. فهي تحرض استجابات مناعية أقوى، و تعتبر نوع مفضل للبالغين الأصحاء. و لكنها قد تكون غير آمنة الاستخدام عند الأفراد المثبطين مناعياً، و بشكل نادر يمكن أن تتحول للشكل المفوع، و تسبب المرض
الذيفانات
اللقاحات الذيفانية مصنوعة من مركبات ذيفان معطل تسبب المرض أكثر من العضوية الدقيقة. تتضمن الأمثلة عن هذه اللقاحات المعتمدة على الذيفانات الكزاز و الدفتيريا. اللقاحات المصنوعة من الذيفانات معروفة بفعاليتها. لا تعود كل الذيفانات لأحياء دقيقة، على سبيل المثال ذيفان الأفعى الصلالة يستخدم لتمنيع الكلاب ضد عضات الأفعى الصلالة.
الوحدات
وحدات البروتين ، بدلاً من تقديم الأحياء الدقيقة المضعفة أو المعطلة للجهاز المناعي(و التي تشكل لقاح كامل العامل ) جزء منه يمكنه أن يشكل الجواب المناعي. مثل اللقاح ضد التهاب الكبد الفيروسي B ، والذي يتألف من البروتينات السطحية على الفيروس فقط (كان سابقاً يستخرج من مصل المرضى المصابين بالفيروس و المصابين بشكل مزمن، و لكنه يصنع الآن من إعادة تركيب المورثات الفيروسية في الخميرة)، لقاح الجزيئات المشابهة للفيروسات(VLP)ضد مرض الفيروس الحليمومي البشري، و الذي يتألف من الغلاف البروتيني الكبير للفيروس، و وحدات الهيماغلوتينين،و النورامينداز لفيروس الانفلونزا. لقاح الوحدات يستخدم للتمنيع ضد الطاعون.
المتقارن
بعض البكتيريا محاطة بأغلفة عديدة السكاريد تستثير المناعة بشكل ضعيف. عبر ربط هذه الأغلفة ببروتينات (كالذيفانات)، سنجعل الجهاز المناعي يتعرف على هذه الأغلفة و كأنها مولدات ضد بروتينية. تستخدم هذه الطريقة في لقاح المستدمية النزلية النمط B.
التجريبي

نظام Electroporation لتقديم اللقاحات التجريبية " لقاحات ال DNA "
عدد من اللقاحات المبتكرة قيد التطوير و الاستخدام:
لقاحات الخلايا المتغصنة تربط الخلايا المتغصنة مع مولدات الضد، لتتعرف الكريات البيضاء على مولدات الضد هذه، و هذا يحرض الاستجابة المناعية. أظهرت هذه اللقاحات نتائج تمهيدية إيجابية في علاج أورام الدماغ و تمت تجربتها أيضاً على أورام الميلانوما الجلدية الخبيثة
الناقل المزجي : و ذلك بمزج خصائص عضية دقيقة وDNAعضية أخرى، يمكن أن تتشكل مناعة تجاه أمراض لها عمليات إمراضية معقدة.
تلقيح ال DNA:
مقاربة تجريبية بديلة للتلقيح دعيت بتلقيح DNA، مأخوذة من المادة الوراثية للعامل الممرض ما زالت قيد التطوير. الآلية المقترحة هي إدخال(و التعبير المحرض باستخدامelectroporation و التي تحث جهاز التعرف المناعي ) المادة الوراثية لبكتيريا أو فيروس لداخل الخلية الإنسانية أو حيوانية. بعض خلايا الجهاز المناعي و التي ستتعرف على البروتينات التي تم التعبير عنها، ستتولى الهجوم ضد هذه البروتينات و الخلايا التي تعبر عنها. و لأن هذه الخلايا تعيش لفترة طويلة جدا، إذا هاجم العامل الممرض في وقت لاحق ، و المعبر عنه بشكل طبيعي بهذه البروتينات، ستتم مهاجمتها بسرعة من قبل الجهاز المناعي. هناك ميزة أساسية للتلقيح DNA، و هي أنها سهلة الاستخدام و التخزين. حتى عام 2015 التلقيح DNAلا يزال تجريبي، واستخدامه غير مصادق عليه للاستخدام البشري.
لقاحات مستقبلات الخلايا التائية الببتيدية هي قيد التطوير لأمراض عديدة كحمى الوادي، التهاب المعدة، التهاب الجلد التأتبي. أظهرت هذه الببتيدات لتعديل تصنيع السيتوكين و تحسين آلية المناعة المتواسطة بالخلايا
استهداف بروتينات معينة من الجرثوم معنيّة بكبت المتممة سوف يعدل آلية فوعة الجرثوم الأساسية.
بينما تصنع أغلب اللقاحات من أجزاء مضعفة أو معطلة للأحياء الدقيقة، تتركب اللقاحات الصنعية بشكل كامل أو جزئي من ببتيدات، سكريات، أو أجسام مضادة مصنعة.
المتكافئ
يمكن أن تكون اللقاحات أحادية التكافؤ (تدعى أيضاً وحيدة التكافؤ)، و يمكن أن تكون متعددة التكافؤ (تدعى أيضاً بعديدة التكافؤ). صمم اللقاح وحيد التكافؤ ليمنع الجسم ضد جسم مضاد واحد أو عضية دقيقة واحدة صمم اللقاح عديد التكافؤ ليمنع الجسم ضد سلالتين أو أكثر لنفس العضية الدقيقة، أو ليمنعه ضد عضيتين دقيقتين أو أكثر تكافؤ اللقاح عديد التكافؤ يمكن أن يرمز له ببادئة يونانية أو لاتينية (ثلاثي أو رباعي التكافؤ ) . بحالات معينة يعتبر اللقاح وحيد التكافؤ مفضلاً لتطوير جواب مناعي قوي بشكل سريع.
غيري النمط
يدعى أيضاً باللقاح المغاير أو الجينري (نسبة للعالم ادوار جينر) هذه اللقاحات هي عوامل ممرضة لحيوانات أخرى و التي لا تسبب مرضاً، أو تسبب مرضاً خفيفاً للعضوية المعطاة. المثال التقليدي هو استخدام جينر لجدري البقر للوقاية من الجدري الإنساني. المثال الحالي هو استخدام لقاح السل المصنوع من Mycobacterium bovis للوقاية من السل الإنساني.
تشكيل المناعة
يتعرف الجهاز المناعي على أجزاء اللقاح كمواد غريبة، و يحطمها، و يتذكرها. عندما تهاجم النسخة السامة منها الجسم يتعرف على بروتينات الغلاف الفيروسي، و هذا يعتبر تجهيز للاستجابة، عبر
1- تعديل العامل المستهدف قبل أن يستطيع الدخول إلى الخلايا.
2-يتعرف على الخلايا المصابة و يهاجمها قبل أن يتكاثر هذا العامل داخلها لأعداد هائلة. عندما يمزج لقاحين معاً أو أكثر بنفس الصيغة، يمكن أن يتفاعل اللقاحان. يحدث هذا بشكل شائع في اللقاحات الحية المضعفة، عندما يكون أحد أجزاء اللقاح أقوى من البقية، و يثبط النمو و الاستجابة المناعية للأجزاء الأخرى. لوحظت هذه الظاهرة أولاً في لقاح شلل الأطفال السابين ثلاثي التكافؤ، عندما توجب إنقاص نسبة النمط المصلي الثاني من الفيروس في اللقاح لكي لا يتداخل مع الاستفادة من النمط المصلي الأول و الثالث من الفيروس في اللقاح. وجدت هذه الظاهرة كمشكلة أيضاً في لقاحات حمى الضنك التي يتم البحث فيها حالياً. حيث وجد أن النمط المصلي DEN-3 يسود و يثبط الاستجابة للأنماط DEN-1, −2 و −4 .
أسهمت اللقاحات في استئصال مرض الجدري، أحد أكثر الأمراض المعدية و المسببة للوفاة التي عرفتها البشرية. أمراض أخرى كالحصبة الألمانية، و الحصبة، و شلل الأطفال، و النكاف، والحماق ، والتيفوئيد لم تعد موجودة كما كانت موجودة منذ مئات السنين. طالما أن الأغلبية الكبيرة من الناس يأخذون اللقاح، سيكون من الصعب ظهور مرض ما أصلاً، عدا عن انتشاره. يدعى هذا التأثير مناعة القطيع. شلل الأطفال، و الذي ينتقل عبر الإنسان فقط، مستهدف بحملة استئصال واسعة و التي جعلت شلل الأطفال المتوطن محصور في أجزاء معينة من ثلاث دول فقط (أفغانستان، نيجيريا، باكستان) صعوبة الوصول إلى جميع الأطفال إضافة إلى سوء الفهم الثقافي للموضوع جعل من الصعب تحديد تاريخ الاستئصال المتوقع له عدة مرات .
الجدول
المقالة الأصلية : جدول اللقاحات الرابط Vaccination schedule لمعلومات تخص البلد عن سياسات التلقيح و ممارستها الرابط : Vaccination policy من أجل وقاية مثلى، ينصح أن يبدأ لاأطفال بأخذ اللقاحات حالما يتطور جهازهم المناعي بشكل كاف ليستجيب للقاحات محددة، بالإضافة لجرعات معززة داعمة إضافية غالباً ما يحتاجونها لتحقيق المناعة الكاملة. أدى هذا الأمر لتطوير جداول تلقيح معقدة. في الولايات المتحدة الأمريكية الجمعية الاستشارية لممارسة علم المناعة، و التي اقترحت إضافات على جدول مراكز معلاجة الأمراض و الوقاية منها، اقترحت تلقيح الأطفال بشكل روتيني ضد التهاب الكبد A و التهاب الكبد B، شلل الأطفال، النكاف، الحصبة، الحصبة الألمانية، الدفتيريا، الشاهوق ، الكزاز ، HIB ، الحماق، فيروس الروتا، الانفلونزا،الخمج بالمكورا السحائية، ذات الرئة. العدد الكبير من اللقاحات واللقاحات الداعمة التي اقترحت (تصل إلى 24 حقنة للطفل حتى عامه الثاني) قاد إلى مشاكل في تحقيق التزام كامل. و لمواجهة معدلات الالتزام المرفوضة، تأسست عدة أنظمة إخطار، و حالياً يباع في الأسواق العديد من اللقاحات الممزوجة (على سبيل المثال اللقاح المتقارن للمكورات السحائية، و لقاح MMRV ) و التي تقدم وقاية ضد عدة عدة أمراض معاً. إضافة إلى التوصيات بتلقيح الأطفال و بالجرعات الداعمة، هناك توصيات بعدة لقاحات معينة بأعمار أخرى، أو توصيات بتكرار الجرعة عدة مرات خلال الحياة، و الأكثر شيوعا لقاحات الحصبة و الكزاز و الانفلونزا و ذات الرئة. غالباً يتم التحري عن استمرار المقاومة لدى النساء الحوامل لفيروس الحصبة الألمانية. لقاح الفيروس الحليمومي البشري ينصح به في الولايات المتحدة (من 2011) و بريطانيا(من 2009) توصيات اللقاحات للأعمار الكبيرة تركز على ذات الرئة والانفلونزا، و التي تعتبر المسبب الأهم للوفاة في هذه الفئة العمرية.في عام 2006 تم تقديم لقاح ضد القوباء المنطقية، مرض يسببه فيروس الحماق، و يصيب الأعمار الكبيرة غالباً.
التاريخ

إدوارد جينر
قبل بداية التلقيح بمواد مستخلصة من حالات جدري البقر( تمنيع غيري النمط)، كانت الإصابة بالجدري تمنع عبر التلقيح المتعمد بفيروس الجدري، و التي دعيت فيما بعد بعملية التجدير لتمييزها عن لقاح الجدري. التلميحات الاقرب من ممارسة تطعيم الجدري في الصين تأتي خلال القرن العاشر كما يمارس الصينيون أقدم استخدام موثق للتجدير، التي يعود تاريخها إلى القرن الخامس عشر. تنفيذ طريقة "نفخ الأنف" التي يتم تناولها عن طريق نفخ المواد الجدرية المسحوقة، وعادة الجلبة، حتى الخياشيم يديرها. وقد سجلت تقنيات النفخ المختلفة على مر القرون السادس عشر والسابع عشر داخل الصين:60 . ورد تقريران عن ممارسة الصين التلقيح من قبل الجمعية الملكية في لندن في 1700. واحدا تلو الدكتور مارتن ليستر الذي حصل على تقرير من قبل موظف في شركة الهند الشرقية المتمركزة في الصين وآخر من قبل Clopton Havers جاءت هذه المعلومة للغرب من الامبراطورية العثمانية عام 1721 بواسطة (ليدي ميري وورنتلي موتاغ ) و التي عرفته ل (هانس سلون) طبيب الملك (البريطاني) .
في وقت ما في أواخر الستينات في 1760م (ادوارد جينر )أثناء تدربه على مهنته كجراح صيدلي، علم عن القصة، و التي شاعت في المناطق الريفية، أن عمال الألبان لن يصابوا بعد ذلك بالمرض القاتل أو المشوه الجدري، لأنهم أصيبوا بجدري البقر، و الذي له تأثير بسيط جداً على الإنسان. في عام 1796، استخلص جينر قيحاً من يد فتاة تعمل حلابة بقر مصابة بجدري الأبقار، لينقله إلى ذراع طفل عمره ثمان سنوات عبر خدش يده، و بعد ستة أسابيع تم تجدير هذا الصبي بفيروس الجدري فلاحظ أنه لم يصب بالجدري وسع جينر دراساته، و في عام 1798 أعلن أن لقاحه آمن للأطفال و البالغين، و أنه قابل للنقل من ذراع لأخرى مقللاً الاعتماد على المخازين غير الموثوقة من الأبقار المصابة و منذ أن أصبح التلقيح بجدري البقر أكثر أماناً من إدخال الجدري وعلى الرغم أن التلقيح بالجدري ظل يجرب في بريطانيا، تم منعه في 1840 تم اكتشاف الجيل الثاني من اللقاحات من قبل لويس باستور في أعوام 1880 ،و الذي طور لقاحات من أجل كوليرا الدجاج، و الجمرة ، و منذ أواخر القرن التاسع عشر أصبح للقاحات هيبة عالمية، و وضعت لها قوانين إلزامية. شهد القرن العشرين اكتشاف لقاحات عديدة ناجحة، بما فيها لقاحات ضد الدفتيريا، و الحصبة، و النكاف، و الحصبة الألمانية. و شهد إنجازات كبيرة كتطوير لقاح لشلل الأطفال في الخمسينات من 1950 ،و استئصال الجدري في و ال 1970 ،1960 في الستينات و السبعينات، كان موريس هيلمان الأكثر إنتاجاً في تطوير اللقاحات في القرن العشرين. و عندما أصبحت اللقاحات أكثر شيوعاً، الكثير من الناس اعتبروها كأمر مسلم به . على أي حال بقيت اللقاحات متهربة من أمراض هامة كالحلأ البسيط، والملاريا، و الإيدز
العلامات المميزة

الجدول الزمني للمطاعية
العامالعلامة المميزة
1000 ممارسة الصينيين لعملية التجدير
1545 وباء الجدري في الهند
1578 وباء السعال الديكي في باريس
1625 بدايات الجدري في شمال أمريكا
1633 استعمار وباء الجدري في ولاية massashusets
1661 امبراطورية كامبغكسي اعطت دعم ملكي من أجل التلقيح
1676 أرشف توماس سدنهام الاصابة بالحصبة
1676 الطاعون الهندي في ايروكوا أرشف من قبل لويس دو بود دو فرونتس
1694 ماتت الملكة ماري الثانية بمرض الجدري في 28 كانون الأول
1699 اندلاع مرض الحمى الصفراء في مستعمرات أمريكا
1718 السيدة ماري مونتاغ تم تلقيح ابنها البالغ من العمر ست سنوات في القسطنطينية من قبل الدكتور شارلز ميتلاند
1721 السيدة ماري مونتاغ تم تلقيح ابنتها عمرها سنتين من قبل الدكتور شارلز ميتلاند في بريطانيا
1736 مات ابن بنجامين فرانكلين عن عمر 4 سنوات بمرض الجدري
1740 أعطى فريدريخ هوفمان الوصف الأول للحصبة الألمانية
1757 وضح فرانسيس هوم الطبيعة الخامجة للحصبة
1798 نشر ادوارد جينر حساباته في تأثير لقاح الجدري الذي ابتكره
1800 أحضر بنجامين ووترهاوس لقاح الجدري إلى أمريكا
1817 بدأ انتشار وباء الكوليرا
1817 درس بانوم إمراضية الحصبة في جزيرة فاروي
1854 فيليبو باسيني عزل ضمات الكوليرا
1874 بدأ تطبيق قانون لقاح إلزامي للجدري و إعادة اللقاح في ألمانيا
1880 طور لويس باستور لقاح حي مضعف لكوليرا الدجاج
1881 محاولة علنية ل لويس باستور لابتكار لقاح للجمرة في بويلي لو فورت
1881 اكتشف لويس باستور و جورج سترنبرغ المكورات الرئوية بشكل مستقل
1882 عزل كوخ الخمج بالمتفطرة السلية (التدرن)
1885 منع لويس باستور الإصابة بداء الكلب في جوزيف ميستر و ذلك عبر التلقيح قبل التعرض
1888 افتتح معهد باستور في 14 تشرين الثاني
1890 شيباسابورو كيتاساتو و ايميل فون بهرنغ منَعوا الخنازير في غينيا بذيفان الدفتيريا المعالج بالحرارة
1892 اكتشف فيفر البكتيريا المسبب لمرض الانفلونزا
1894 وثق اندلاع شلل الأطفال بشكل كبير لأول مرة في أمريكا في مدينة روتلاند ، فيرموت
1896 اكتشف كوخ لقاح الكوليرا و هو غير مدرك لاكتشافه من قبل من قبل فليبو باسيني
1898 سمح في بريطانيا الإعفاء من لقاح الجدري على أساس الوعي
1899 وبائيات الحمى الصقراء بين عمال قناة باناما نتج عنها نقل حقوق المشروع من فرنسا إلى الولايات المتحدة
1900 اكتشف كارلورس فانواي و ولتر رييد أن الحمى الصفراء تنتقل عبر البعوض بعد دراستها في كوبا
1906 جولز بورديت و اوكتاف جينغو عزلوا البورتيدلية المسببة للسعال الديكي
1908 كارل لاندستنر و اروين بوبر اكتشفوا الفيروس المسبب لشلل الأطفال
1924 عرف ال BCG كلقاح السل الحي
1935 طورماكس تيلر لقاح حي مضعف للحمى الصفراء D17
1945 تم تطوير لقاح للانفلونزا المسببة باستسقاء السائل الأمنيوسي
1949 زرع جون اندرز فيروس شلل الأطفال في بنية نسيجية
1955 عطل جون سالك استخدام لقاح شلل الأطفال المرخص من استخدام العموم
1960 بدأت محاولات البرت سابين لاكتشاف لقاح حي مضعف لشلل الأطفال
1960–1969 طورت لقاحات حية مضعفة للحصبة و النكاف و الحصبة الألمانية
1974–1984 طورت لقاحات عديدة السكاريد للمكورات السحائية، المكورات الرئوية و المستدميات النزلية
1980 أعلنت منظمة الصحة العالمية الاستئصال العالمي للجدري
1981 تم ترخيص لقاح التهاب الكبد B
1983 وضح هارالزد زور هوسن أن سرطان عنق الرحم يحرض بسبب الفيروس الحليمومي البشري
1983 تم تطوير اقتران السكريات مع البروتينات في الانفلونزا المسبببة ب المستدمية النزلية
1986 تم ترخيص لقاح التهاب الكبد B المعاد تركيبه و المشتق من الخميرة
1989 كونسبسيون كامبا و فريقها ابتكر اللقاح الأول ضد التهاب السحايا بالنيسيريات السحائية النمط B
1991 تم تطوير و ترخيص لقاح للكوليرا dukoral في السويد
1994 جاكينتة كونفيت طور لقاحاً للايشمانيا معتمداً على مبدأ لقاح السل BCG
1994 أعلن عن استئصال شلل الأطفال في الأمريكيتين
2002 أعلن عن استئصال شلل الأطفال في اوروبا
2006 تم ترخيص أول لقاح ضد لفيروس الحليمومي البشري
2014 إعلان استئصال شلل الأطفال من الهند
المجتمع والثقافة
المعارضة
Vaccine controversies

James Gillray, بثرة البقرة..او.. النتائج الرائحة للقاحات الجديدة ! (1802)
وجدت معارضة لموضوع اللقاحات من مجموعة كبيرة من النقاد منذ بداية حملات التلقيح. على الرغم من فوائد منع المعاناة و الموت بسبب الأمراض المعدية الخطيرة و التي وضحت بشكل كبير ندرة التأثيرات الضارة التالية للتمنيع، نشأت الكثير من النزاعات حول تسبيب اللقاحات الموت، أخلاقياتها، فعاليتها ، وأمانها. بعض نقاد اللقاحات قالوا أنها غير فعالة ضد الأمراض، أو أن دراسات اللقاحات من حيث الأمان غير كافية بعض المجموعات الدينية لم تسمح باللقاحات و بعض المجموعات السياسية عارضت التلقيح الإلزامي على أساس الحرية الفردية كنتيجة، زاد الاهتمام بأن المعلومات المنتشرة غير الصحيحة عن مخاطر التلقيح من الناحية الطبية تزيد معدلات الأمراض المعدية المهددة للحياة، ليس فقط لدى الأطفال الذين رفض أهلهم تلقيحهم، و انما أيضاً عند الذين لا يمكن تلقيحهم بسبب عمرهم أو بسبب نقص المناعة لديهم، و الذين يمكن أن ينتقل لهم المرض من الحملة غير الملقحين(انظر مناعة القطيع). يعتقد بعض الأهل أن اللقاحات تسبب التوحد رغم الإجماع العلمي على رفض هذه الفكرة في عام 2011 اندريو ووكفالد، مؤيد رائد للخلافات التي تتحدث عن الارتباط المزعوم بين التلقيح و التوحد، اكتشف أنه يتلقى دعم مادي ليعطي معلومات ونتائج أبحاث خاطئة و سحبت منه شهادته الطبية
الاقتصاد و التطوير
من التحديات الكبيرة التي واجهت اللقاحات الاقتصاد، العديد من الأمراض التي تتطلب لقاحات كالايدز و الملاريا ظهرت أساساً في البلدان الفقيرة. كان الحافز لدى الشركات الدوائية، و الشركات الحيوية التقنية لتطوير لقاحات لهذه الأمراض صغيراً جداً، لأن الايرادات المالية قليلة. حتى في الدول الأكثر ثراء كانت العائدات الاقتصداية ضئيلة، بينما كانت المخاطر كبيرة سواء اقتصادية أو غيرها اعتمدت أغلب اللقاحات حتى الآن على التمويل المدفوع من قبل الحكومات، الجامعات، المنظمات غير الربحية العديد من اللقاحات التي بدت عالية التكاليف كانت مفيدة و فعالة للصحة العامة ازداد عدد اللقاحات التي تدار بشكل كبير في العصور الحديثة هذه الزيادة، و خصوصاً في عدد اللقاحات التي تعطى للأطفال قبل دخول المدرسة ممكن أن تكون بسبب التولي و الدعم الحكومي أكثر من الحافز الاقتصادي citation needed .
براءات الاختراع
كثرة براءات الاختراع بعمليات تطوير اللقاحات يمكن أن يرى أيضاً كعقبة في وجه تطوير اللقاحات، بسبب الحماية الضعيفة لبراءة الاختراع لهذا المنتج النهائي.حماية الاكتشاف المتعلق باللقاح غالباً يصنع عبر براءة الاختراع للعمليات المستخدمة بتطوير لقاحات جديدة بالإضافة إلى حماية السرية ووفقا لمنظمة الصحة العالمية، لم يكن العائق الأكبر أمام إنتاج اللقاح المحلي في البلدان الأقل نموا براءات الاختراع، ولكن المالية، ومتطلبات جوهرية البنية التحتية، وخبرات القوى العاملة اللازمة لدخول السوق. اللقاحات هي مزيج معقد من المركبات البيولوجية، وعلى عكس حالة من الادوية ، وليس هناك أي لقاحات عامة حقيقية . اللقاح الذي تنتجه منشأة جديدة يجب أن يخضع لاختبارات سريرية كاملة عن سلامة وفعالية مماثلة لتلك التي مر بها والتي أنتجت من قبل الشركة المصنعة الأصلية . بالنسبة لمعظم اللقاحات، وقد تم تسجيل براءة اختراع عمليات محددة. يمكن التحايل على طرق التصنيع البديلة، ولكن هذا يتطلب بنية تحتية R & D وقوة عاملة ماهرة بشكل مناسب. في حالة وجود عدد قليل من لقاحات جديدة نسبيا مثل لقاح فيروس الورم الحليمي البشري، قد تفرض براءات الاختراع حاجزا إضافيا
تصنيع اللقاحات

عاملان يقومان بعمل فتحات في بيوض الدجاج لاستخدامها في صناعة لقاح الحصبة.
تصنيع اللقاحات له مراحل عديدة. في البداية ينتج مولد الضد. تنمو الفيروسات إما عبر خلايا أولية مثل بيوض الدجاج(كالانفلونزا) أو عبر خطوط خلوية مستمرة مثل خلايا الإنسان المزروعة كفيروس التهاب الكبد أ. تنمو البكتيريا في المفاعلات الحيوية (مثل انفلونزا المستدميات النزلية النمط B).كذلك البروتين المعاد تشكيله المشتق من الفيروسات و الجراثيم يمكن أن ينتج من الخميرة، البكتيريا، اوالخلايا المزروعة. بعد أن ينتج مولد الضد يعزل من الخلايا المنتجة له. يمكن أن نحتاج لتعطيل الفيروس، و غالباً دون إجراءات تنقية إضافية مطلوبة. بروتينات إعادة التشكيل تحتاج لعمليات إضافية تتضمن الترشيح الفائق و التلوين العمودي. في النهاية يتشكل اللقاح بإضافة مساعدات، مثبتات، مواد حافظة حسب الحاجة. المساعدات تحرض الجواب المناعي لمولد الضد، المثبتات تزيد مدة التخزين(الصلاحية)، و المواد الحافظة تسمح باستخدام عبوات اللقاح متعددة الجرعات. اللقاحات المختلطة أو المركبة أصعب من ناحية التصنيع و التطوير بسبب احتمال عدم التوافق أو التفاعلات بين مولدات الضد و المحتويات الأخرى الموجودة.
تقنيات تصنيع اللقاح في تطوير مستمر. مستنبتات(مستحضرات) خلايا الثديات يتوقع أن تصبح مهمة بشكل كبير مقارنة بالخيارات التقليدية كبيوض الدجاج، و ذلك بسبب الإنتاجية الأكبر، و قلة وقوع المشاكل المتعلقة بالتلوث. تقنية إعادة التركيب التي تصنع لقاح مزال السمية وراثياً يتوقع أن تنمو و تشيع لتصنيع لقاحات للبكتيريا التي تستخدم الذيفانات. اللقاحات المركبة يتوقع أن تنقص الكميات التي تحويها من مولدات الضد و بالتالي تنقص التفاعلات غير المرغوبة باستخدام النماذج الجزيئية المرتبطة بالعامل الممرض في عام 2010 صنعت الهند 60% من لقاحات العالم كلفت حوالي 900 مليون دولار (670 مليون يورو).
السواغات
إلى جانب اللقاح الفعال نفسه، السواغات التالية شائعة الوجود في تكوينات اللقاحات:
أملاح أو هلام الألمنيوم تضاف كمساعدات. تضاف المساعدات لتحرض استجابة مناعية للقاح أبكر و أقوى و أكثر استمراراً، فتسمح بذلك بالتقليل من جرعة اللقاح المعطاة.
الأجسام المضادة: تضاف لبعض الللقاحات لتمنع نمو الجراثيم أثناء تصنيع و تخزين اللقاح.
بروتين البيض يوجد في لقاحات الانفلونزا و الحمى الصفراء لأنها تحضر باستخدام بيوض الدجاج، و بروتينات أخرى يمكن أن تتواجد أيضاً.
الفورم الدهيد يستخدم لتعطيل منتجات البكتيريا في لقاحات الذيفانات.يستخدم الفورم الدهيد أيضاً لتعطيل الفيروسات غير المرغوبة، و قتل البكتيريا التي يمكن أن تلوث اللقاح خلال التصنيع.
غلوتامات أحادي الصوديوم MSG و 2 فينواوكسي ايتانول يستخدمان أيضاً كمثبتان في القليل من اللقاحات، لمساعدة اللقاح على البقاء ثابتاً عندما يتعرض للحرارة، الضوء، الحموضة، الرطوبة.
ثيميروسال: مواد حافظة تحتوي على الزئبق، تضاف إلى عبوة اللقاح التي تحوي أكثر من جرعة واحدة لتمنع تلوثه، و نمو بكتيريا كامنة مؤذية.بسبب الجدل حول الثيميروسال أزيل من معظم اللقاحات.
دور المواد الحافظة
العديد من اللقاحات تحتاج المواد الحافظة لمنع التأثيرات الضارة الخطيرة كالخمج بالمكورات العنقودية، و الذي قتل في حادث واحد عام 1928 اثنا عشر طفل من أصل واحد و عشرين لقحوا بلقاح الدفتيريا دون مواد حافظة. المواد الحافظة المتوفرة تتضمن ثيميروسال، فينوكسي ايتانول، و الفورم الدهيد.الثيميروسال أكثر فعالية تجاه البكتيريا، عمر تخزينه أو مدة صلاحيته أطول، و يحسن ثباتية اللقاح، و قوته ،و أمانه.و لكن في أمريكا، و دول الاتحاد الأوروبي، و غيرها من الدول الثرية لم يعد يستخدم كمواد حافظة في لقاحات الأطفال ، و اعتبر ذلك كإجراء وقائي بسبب احتوائه على الزئبق. على الرغم من أن الادعاءات الجدلية توصلت إلى أن الثيميروسال يسبب التوحد، لا يوجد دليل علمي مقنع يدعم هذه الادعاءات.
أنظمة التوصيل

امرأة تأخذ لقاح الحصبة الالمانية في البرازيل 2008 .
تطوير أنظمة التوصيل الحديثة زاد الأمل باللقاحات الأكثر أماناً و فعالية التنقل و تستخدم. خطوط البحث تتضمن الجسيمات الشحميةliposomes و معقد الحث المناعيISCOM التطورات الملحوظة في تقنيات توصيل اللقاح تضمنت اللقاحات الفموية. المحاولات الباكرة لتطبيق اللقاحات الفموية أظهرت درجات متنوعة من الوعود، ابتدأت باكرة في القرن العشرين، في الوقت الذي كانت فيه احتمالية فعالية أي لقاح فموي مثار جدل في الثلاثينيات من 1930 كان هناك اهتمام متزايد في القيمة الوقائية للقاح، على سبيل المثال حمى التيفوئيد.
لقاحات شلل الأطفال الفموية تغيرت لتصبح فعالة عندما أصبحت تدار من قبل فريق عمل تطوعي دون تدريب رسمي، أظهرت النتائج أيضاً السهولة المتزايدة و الفعالية لعملية إدارة اللقاحات. اللقاحات الفموية الفعالة لها عدة محاسن، على سبيل المثال لا يوجد خطر تلوث الدم. اللقاحات المعدة للاستخدام الفموي يجب ألا تكون سائلة، لأن الصلبة تكون أكثر ثباتية و أقل عرضة للتخرب أو التلف بالتجميد أثناء النقل أو التخزين هذه الثباتية تقلل الحاجة ل"سلسلة التبريد": التي تحتاجها الموارد لتحفظ اللقاحات في مجال درجة حرارة معينة من مرحلة التصنيع إلى نقطة الإدارة، و هذا بالتالي يمكن أن يقلل من كلفة اللقاح. طريقة الإبرة المجهرية، لا تزال في مرحلة التطوير، تستخدم "إسقاطات حادة وهمية مختلقة بترتيب تستطيع أن توصل مسارات لتوصيل اللقاح عبر الجلد" جهاز توصيل اللقاح بدون إبرة التجريبي يجرب حالياً على الحيوانات بقعة بحجم الطابع تشابه ضماد لاصق تحوي على 20،000 أسقاطات مجهرية في الانش المربع. هذه الإدارة الجلدية تزيد بشكل كبير فعالية التلقيح، كما تتطلب كمية لقاحات أقل من الحقن
البلاسميدات
أصبح استخدام البلاسميدات شرعياً في الدراسات قبل السريرية كاستراتيجية لقاح واقي من السرطانات و الأمراض المعدية.على أية حال، في الدراسات الإنسانية لم تنجح هذه المقاربة في تقديم فائدة سريرية ذات صلة بالموضوع نفسه.الفعالية الإجمالية للتمنيع ببلاسميدات DNA تعتمد على زيادة مناعية البلاسميدات بينما تصلح أيضاً العوامل المساهمة في التفعيل الخاص بالخلايا المؤثرة بالمناعة.
الطب البيطري

التطعيم ضد جدري أغنام الماعز والالتهاب الرئوي البلوري
استخدمت اللقاحات عند الحيوانات لغرض منع تعرضهم للأمراض، و لمنع نقلها للإنسان أيضا كلا الحيوانات سواء المحفوظة كالحيوانات الأليفة، أو المتروكة كالماشية يتم تلقيحها بشكل روتيني.في بعض الحالات يمكن تلقيح سكان البرية ، هذا ينفذ في بعض الحالات في الأطعمة المرتبطة بالمرض في المناطق الموبوءة بالمرض، كما تم ضبط داء الكلب عند الراكونات. أينما يحصل داء الكلب يصبح لقاح الكلب مطلوباً بالقانون. من اللقاحات الكلبية الأخرى: مرض الكلاب، الفيروسات الصغيرة الكلبية، الخمج بالتهاب الكبد الكلبي، الفيروس الغدي 2، داء البريميات، البورديتيلة، فيروس نظيرة النزلة الوافدة الكلبية، داء لايم، و غيرها. حالات اللقاح الحيوانية المستخدمة لدى الإنسان موثقة، سواء بشكل مقصود أو صدفة في بعض الحالات، الأمراض الناتجة و الأكثر مصادفة داء البروسيلات على أية حال التقارير عن حالات كهذه نادرة، و تمت عدة دراسات قليلة جداً حول أمانها و نتائج ممارستها. مع ظهور اللقاح الذي يؤخذ استنشاقاً في عيادات البيطريين للحيوانات الأليفة ، زاد في السنوات الأخيرة تعرض الإنسان للعوامل الممرضة التي لا يحملها بشكل طبيعي كالبورديتيلة الخامجة للقصبات. في بعض الحالات، داء الكلب يعتبر الأكثر مشاهدة عند الحيوان، اللقاح الحيواني المشابه ضد عامل ممرض ممكن أن يكون بنفس مقاييس الأهمية، و اقتصادي أكثر من الإنساني.
لقاحات ال DIVA
DIVA (تمييز الحيوانات المصابة بالمرض عن الحيوانات التي أخذت اللقاح) هذه اللقاحات جعلت من الممكن تمييز الحيوانات المريضة عن الملقحة. لقاحات ال DIVA تحمل على الأقل حاتمة واحدة أقل من العضويات الدقيقة المنتشرة في المجال. هناك فحص تشخيصي مرافق يحدد لنا الجسم المضاد ضد هذه الحاتمة و هو ما يمكننا من التمييز.
لقاحات ال DIVA الأولى
لقاحات ال DIVA الأولى (و التي دعيت سابقاً لقاحات العلامة أو الدلالة و منذ عام 1999 سميت لقاحات الDIVA) و الفحوص التشخيصية المرافقة تم تطويرها من قبل J.T. van Oirschotو طلاب في المعهد البيطري المتوسط في ليليستاد، نيثرلاند. وجدوا أن بعض اللقاحات الموجودة ضد داء الكلب الكاذب (و الذي يطلق عليه مرض أوجزكيز أيضاً طرأ عليها حذف في صيغتها الجينية الفيروسية (من بينها صيغة ال gE). أجسام مضادة وحيدة النسيلة تم انتاجها لمنع هذا الحذف وتم اختيارها التطوير اليزا توضح أو تشرح وجود أجسام مضادة ضد gE . بالإضافة لذلك تم بناء قصة مصممة وراثياً حول لقاحات سلبية ال gE.
بنفس الطريقة، تم تطوير لقاحات ال DIVA و الفحوص التشخيصية المرافقة ضد خمج فيروسات الحلأ البقرية1.
استخدامها في الممارسة
طبقت استراتيجية ال DIVA ببلدان عديدة، و نجحت باستئصال فيروس داء الكلب الكاذب. تم تلقيح الخنازير بشكل مكثف و تمت مراقبتهم عبر الفحوص التشخيصية المرافقة و من ثم إزالة الخنازير المريضة من السكان .لقاحات ال DIVA لفيروسات الحلأ البقرية 1 أيضاً واسعة الاستخدام سريرياً في الممارسة.
لقاحات DIVA أخرى (قيد التطوير)
وضع العلماء ولا يزالون يحاولون وضع الكثير من الجهود لتطبيق مبادئ الDIVA على مجال أوسع من الأمراض المعدية، على سبيل المثال الحمى الخنزيرية الكلاسيكية انفلونزا الطيور Actinobacillus pleuropneumonia ذات الجنب بالجراثيم المشعشعةActinobacilluspleuropneumonia و الاصابة بالسالمونيلا عند الخنازير
الاتجاهات
اتخذ تطوير اللقاحات عدة اتجاهات
حتى المدى القريب معظم اللقاحات كانت تستهدف الرضع و الأطفال الصغار، و لكن بدأت تستهدف المراهقين و الكبار بشكل أكبر
دمج اللقاحات مع بعضها أصبح أكثر شيوعاً، اللقاحات التي تحوي خمسة مكونات أو أكثر أصبحت مستخدمة بعدة أجزاء في العالم في عام 2013 أطلقت Biofarma منتج دعي ب pentabio و هو مزيج من اللقاحات: الدفتيريا، الكزاز، السعال الديكي، التهاب الكبد B و انفلونزا المستدميات النزلية النمط B و ذلك للرضع و الأطفال في برنامج التلقيح الاندونيسي
يتم تطوير طرق جديدة في إدارة اللقاحات كلصقات الجلد، بخاخات بواسطة اجهزة استنشاق، و تناول نباتات معدلة وراثياً
أصبحت اللقاحات تصمم لتحرض الاستجابة المناعية الفطرية و المكتسبة أيضاً
تمت عدة محاولات لتطوير لقاحات للمساعدة في معالجة الامراض المزمنة كمعارضة لمنع حدوث المرض
يتم تطوير لقاحات لتدافع عن الجسم ضد الهجمات البيولوجية الإرهابية كالجمرة و الطاعون و الجدري
تقدير اختلافات الجنس و الحمل في استجابات اللقاح ممكن أن تغير الاستراتيجيات المستخدمة من قبل موظفي الصحة العامة
يحاول العلماء الآن تطوير لقاحات اصطناعية بإعادة تشكيل البنية الخارجية للفيروس
المبادئ التي تتحكم بالاستجابة المناعية يمكن أن تستخدم الآن في اللقاحات المصنوعة ضد عدة أمراض إنسانية غير معدية، كالأورام و الأمراض المناعية الذاتية حسب الطلب على سبيل المثال اللقاح التجريبي CYToo6-AngQb تم التحقيق حوله كعلاج محتمل لارتفاع ضغط الدم العوامل المؤثرة على تطوير اتجاهات اللقاح تتضمن التطور في الطب المتنقل، التركيبة السكانية، علم التنظيم، الاستجابات السياسية، و الثقافية، و الاجتماعية
النباتات كمفاعلات حيوية لصنع اللقاحات
تعد النباتات المعدلة وراثياً أنظمة تعبيرية واعدة لتصنيع اللقاحات. النباتات المعقدة كالتبغ و البطاطا و البندورة و الموز يمكن أن يكون لديها مورثات مندمجة تجعل من الممكن تصنيع لقاحات مفيدة للإنسان منها. تم تطوير الموز لصناعة لقاح بشري ضد التهاب الكبد B.[98] مثال آخر : تعبير البروتين المنصهر (المندمج) في نباتات الفصة المعدلة وراثياً ، للتوجيه الانتقائي للخلايا المقدمة للمستضد و بهذا زيادة قوة اللقاح ضد فيروس اللإسهال البقري BVDV.
-------------------
لقاح موهن.
من ويكيبيديا، الموسوعة الحرة
اللَّقاح الموَهَّن هو لقاح ينتج عن طريق تقليل فَوْعَة الممراض مع تركها حية والتوهين يدخل إلى العامل المعدي ويبدله بحيث يصبح عديم الضرر أو أقل تفوُّعًا. وهذه اللقاحات تتباين عن اللقاحات التي تنتج عن طريق "قتل" الفيروس (لقاح خامل).
أمثلة
ومن بين أمثلة اللقاحات "الحية" (أو الموَهَّنة):
فيروسي: لقاح الحصبة ولقاح النكاف ولقاح الحصبة الألمانية ولقاح الأنفلونزا ولقاح الحماق ولقاح شلل الأطفال الفموي (سابين) ولقاح الحمى الصفراء, وبخاخ لقاح الأنفلونزا الأنفي (بما في ذلك البخاخ الأنفي للأنفلونزا الموسمية والبخاخ الأنفي أنفلونزا H1N1 2009). لقاح الكلب متوفر الآن في صورتين موهنتين إحداهما للاستخدام البشري والأخرى للاستخدام البيطري.
جرثومي: لقاح بي سي جي ولقاح التِّيفيِّة ولقاح التيفوس الوبائي.
النمو
يمكن توهين الفيروسات بواسطة إمرار الفيروس عبر مضيف مضيف أجنبي مثل:
زراعة الأنسجة
بيض مضغيّ
حيوانات حيّة
تخصص الجمهرة المكروبية البدئية للمضيف الأجنبي. وتتمكن واحدة أو أكثر منها من إحداث طفرة تمكنها من إصابة المضيف الجديد. وتنتشر هذه الطفرات، ولما كانت الطفرات تتيح للميكروبات النمو جيدًا في المضيف الجديد، يكون الناتج هو جمهرة مختلفة تمامًا عن الجمهرة الأولية، ولذا فإنها لا تنمو جيدًا في المضيف الأصلي عندما تُعاد ثانية إليه (ومن هنا يكون "موهَّنًا"). وهذا يُسهِّل على جهاز المناعة لدى المضيف عملية التخلص من العامل ومن ثم خلق خلايا الذاكرة المناعية المسؤولة عن حماية المريض إذا ما أصيب بنسخة مشابهة من هذا الميكروب في الظروف "الطبيعية".
التناول
بالنسبة للقاح الموَهَّن، يتناول الشخص جسيمات فيروس حي ذي فوَّعة محدودة جدًا. وتتكاثر هذه الفيروسات ولكن ببطء شديد. وقد يتطلب الأمر في بعض الأحيان استخدام معززات نظرًا لأن الفيروسات تتكاثر ولا تنفك عن إخراج مستضدات تفوق التلقيح الأولي. وتُنتج هذه اللقاحات بزراعة الفيروس في مزارع نسيجية تنتقى على أساس قلة تفوُّع الذرية، أو عن طريق إجراء تبديل أو خبن متعمّد في الجينات المطلوبة لتعديل فوعتها. وهناك احتمال بسيط لخطر انعكاس الفوعة، وتقل نسبة هذا الخطر في اللقاحات ذات الخبن. ولا يمكن للأفراد منقوصي المناعة استخدام اللقاحات الموَهَّنة.
مزايا اللقاحات الموهَّنة
تنشيط جميع أطوار الجهاز المناعي (تنتج أجسامًا مضادة موضعية مثل الكريين المناعي أ)
ترفع من كفاءة المناعة، وفي أحيان قليلة يتطلب الأمر استخدام معززات
انخفاض التكلفة
سرعة المناعة
سهولة النقل والتناول (فمثلاً يمكن تناول لقاح شلل الأطفال لعلاج شلل الأطفال عن طريق الفم بدلاً من الحقن المعقّم من اختصاصي صحي كما هو الحال في الطريقة المعطِّلة التي يعتمد عليها لقاح الفيروسة السنجابية المعطَّلة)
طريقة "التبقيع" الأولية التي اكتشفها إيسان أناند لها بعض الآثار الجانبية مقارنة بلقاحات الأجسام المضادة المحقونة (مثل الكُزَاز)
عيوب اللقاحات الموهَّنة
قد تتسبب الطفرة الثانوية في انعكاس الفوعة.
قد تتسبب في مضاعفات حادة للمرضى منقوصي المناعة.
قد تكون صعبة التنقل بسبب ضرورة حفظها في ظروف معينة (مثل درجة الحرارة)
------------
تلقيح الحمض النووي.
من ويكيبيديا، الموسوعة الحرة

صنع لقاح الدنا(عن ويكبيديا)
تلقيح الحمض النووي هو تقنية تستخدم لحماية الكائن الحي من الأمراض عن طريق حقنه بحمض نووي (دنا) مُهَنْدَس وراثيّا لإنتاج استجابة مناعيّة. ما تزال لقاحات الحمض النووي في طور التجريب وقد تم تطبيقها على عدد من نماذج لأمراض فيروسية وبكتيرية وطفيلية ونماذج مختلفة من الورم. لتلقيح الحمض النووي عدد من الفوائد التي تفوق التلقيح التقليدي والتي تشمل القدرة على إنتاج مدى أوسع من أنواع الاستجابة المناعية.
تعتبر اللقاحات واحدة من أعظم إنجازات الطب الحديث؛ حيث ساهمت اللقاحات في الأمم الصّناعيّة في الحد من حالات الجدري التي تحدث طبيعيا وقضت تقريبا على حالات شلل الأطفال، بينما تمت السيطرة بشكل جيد على أمراض أخرى مثل التيفوس وفيروس الروتا والتهاب الكبد(أ) و(ب) تغطي اللقاحات التقليدية على أي حال عددا صغيرا من الأمراض وتتسبب العدوى التي لا تتوفر لقاحات فعالة لمعالجتها بقتل ملايين البشر كل عام وتعد أمراض الإيدزوالتهاب الكبد الفيروسي(ج) والملاريا أمثلة شائعة على هذه الأمراض بشكل خاص.
تعتبر لقاحات الجيل الأول لقاحات متعضيّة وهي إما لقاحات حيّة وتم إضعافها (مضعّفة) أو نماذج تم قتلها (مقتولة) اللقاحات الحية والضعيفة مثل لقاحات الجدري وشلل الأطفال بمقدورها إنتاج استجابة للخلايا التائيّة القاتلة (TC أو CTL) واستجابات الخلايا التائية المساعدة (TH) ومناعة الجسم المضاد. غير أن هناك خطرا بسيطا يتمثّل بأن النماذج المضعّفة من مسببات المرض يمكن لها أن تعود لتكوّن شكلا خطرا وتكون قادرة على أن تسبب المرض للأشخاص الذي يعانون من نقص المناعة (كالمصابين بالإيدز). لا تشكّل اللقاحات التي تم قتلها ذات الخطورة، فلا يمكنها أن تنتج استجابات مخصوصة للخلايا التائية القاتلة، ويمكن أن لا تفيد إطلاقا في علاج بعض الأمراض تم تطوير ما يسمّى بلقاحات الجيل الثاني بهدف تقليل هذه المخاطر. لقاحات الوحيدات هذه تتألّف من مستضدات بروتين معرّفة (مثل الكزاز أو توكسيد الدفتيريا) أو مكوّنات البروتين المطعّمة (مثل مضادات الالتهاب الكبدي (ب) السّطحيّة). تعتبر هذه أيضا قادرة على إنتاج خلايا TH واستجابات الأجسام المضادة ولكن ليس استجابات الخلايا التائيّة القاتلة.
تعتبر لقاحات الحمض النووي من لقاحات الجيل الثالث، وتتكون من قطع صغيرة ودائرية من الحمض النووي البكتيري (وتدعى بالبلازميد) والتي تمت هندستها وراثيا لتنتج بروتينا أو اثنين (مستضدات) من مسببات المرض. يحقن لقاح الحمض النووي في خلايا الجسم، بحيث "تقرأ" "الآلية الداخلية" للخلايا المضيفة الحمض النووي وتحوله إلى بروتينات لمسببات المرض. يتم تنبيه جهاز المناعة بحيث يطلق مجموعة من الاستجابات المناعية وذلك عندما يتم تمييز هذه البروتينات كأجسام غريبة عند معالجتها بواسطة الخلايا المضيفة وعرضها على سطحها طورت لقاحات الحمض النووي من تجارب "فاشلة" للعلاج الجيني وأول برهان على استجابة مناعية يسببها البلازميد كانت عندما تم تلقيح فئران ببلازميد يمثّل هرمون النمو البشري منزوع الأجسام المضادة بدلا من تغيير النمو.
(عن ويكبيديا)
الاستخدام الحالي
حتى الآن، أثارت بضع محاولات تجريبية استجابة قوية بما يكفي للحماية ضد الأمراض، وبينما لا يزال عدم جدوى التقنية -وهو شيء محير- غير مثبت بشكل قاطع في التجارب على الإنسان. غير أنه في يونيو 2006 أعلنت نتائج إيجابية لتلقيح الحمض النووي الخاص بإنفلونزا الطيور كما وتم التصديق على لقاح دنا بيطري لحماية الخيول من فيروس غرب النيل في أغسطس عام 2007، أفيد بنجاح الدراسة الأولية لتلقيح الدنا ضد مرض التصلب المتعدد.
منافع ومضار لقاحات الحمض النووي
جدول رقم 1. منافع ومضار التحصين المعتمد على الحمض النوويمنافعمضار
التلقيح الجزئي دون خطر العدوى
تقديم مولد الضد في كل من جزيئات معقدات التوافق النسيجي الكبير من النمط الأول و النمط الثاني
قابلية بلمرة الخلايا التائيّة المساعدة باتجاه النوع الأول أو النوع الثاني
تركَّز الاستجابة المناعية على المُسْتَضد ذي العلاقة
سهولة التطوير والإنتاج
ثبات اللقاح في مواجهة ظروف التخزين والنقل
فعاليّة الكلفة
يزيل الحاجة إلى تركيب الببتيد وتنقية وتقديم البروتينات المطعّمة واستخدام المواد المساعدة السامة
استمرارية المُسْتَضد على المدى البعيد
يضمن أن يكون البروتين في التعبير الحي أكثر شبها بالتركيب العادي لحقيقي النواة مع التعديلات بعد النسخية المرافقة
ينحصر فقط في مستمنعات البروتين (غير مفيد في المُسْتَضدات غير ذات الأساس البروتيني مثل سكريات البكتيريا)
احتمالية حث إنتاج الجسم المضاد ضد الدنا
إمكانية التسامح للمُسْتَضد المنتَج
احتمالية معالجة شاذة للبروتينات البكتيريّة والطفيليّة
نواقل البلازميد المستخدمة في التطعيم
تصميم الناقل
تنتخب لقاحات الحمض النووي أفضل استجابة مناعية عند استخدام نواقل تعبير نشطة للغاية وهي بلازميدات تتكون عادة من محفز فيروسي قوي يقود عمليات نسخ وترجمة الجين (أو الدنا المتمم) ذي العلاقة في الكائنات الحية ربما يتم أحيانا دمج الإنترون(أ) لتحسين ثبات الرنا الرسول (بالإنجليزية: mRNA) وبالتالي زيادة تقديم البروتين.
يمكن للبلازميدات أن تحتوي أيضا على إشارة إنهاء متعددة الأدننة/نسخيّة قوية مثل هرمون النمو البقري أو سلاسل بيتا جلوبولين الأرنبية متعددة الأدننة. تبنى نواقل متعدد السيترونات أحيانا لتقدّم أكثر من مستمنع أو لتعرض مستمنعا وبروتينا مناعيا محفزا.
لأن البلازميد يعتبر "وسيلة النقل" التي يتم تقديم المستمنع من خلالها، يعتبر تحسين تصميم النواقل للحصول على أقصى تقديم بروتيني أمرا ضروريا يعتبر تحسين استخدام الكودون (أو الرّامز) لأحماض الرنا الرسولة المسببة للمرض في الخلايا حقيقة النواة أحد طرق تحسين التعبير البروتيني. غالبا ما تمتلك مسببات الأمراض محتويات AT أكثر من الأنواع التي تم تمنيعها، ولذا فإن تعديل التسلسل الجيني للمستمنع ليؤثر على الكودونات التي تستخدم بشكل أكثر شيوعا في الأنواع المستهدفة قد يحسّن من تعبيرها.
أمر آخر يجب أخذه في الاعتبار هو اختيار المحفّز، تم استخدام المحفّز الخاص بالفيروس القردي 40 (بالإنجليزية: SV40) حتى أثبتت الدراسات أن المحفّز الخاص بفيروس روس ساركوما (بالإنجليزية:RSV) يحوي معدلات تقديم أعلى.أمكن مؤخرا زيادة معدلات التقديم عن طريق استخدام المحفّز المبكّر الفوريّ للفيروس المضخم للخلايا (بالإنجليزية: CMV). تضمين فيروس قرد ميسون – فايزر (بالإنجليزية: MPV-CTE)مع/بدون تسريع قد زاد من غطاء التعبير الجيني. زيادة على ذلك فإن تركيب CTE المسرَّع كان أكثر قدرة على توليد المناعة من فيروس قرد ميسون – فايزر بمفرده ضُمّنَت تعديلات إضافية لتحسين معدلات التعبير مثل إدخال سلاسل المعزّز، سلاسل تصنيع الإنترونات وقائد ثلاثي الفيروس الغدي (بالإنجليزية:TPL) والتعديلات على سلاسل الإنهاء متعددة الأدننة والنسخية. مثال على بلازميد تلقيح الدنا هو مركب بولي فينيل أسيتات (بالإنجليزية:pVAC) الذي يستخدم المحفّز SV40.
تصميم إدخال اللقاح
يمكن أن توجّه المُستمنعات لتستهدف مقصورات خلوية مختلفة بهدف تحسين استجابات الجسم المضاد أو الخلايا التائيّة السامة. إن المستضدات المفرزة والمستضدات المحاطة بغشاء بلازمي هي أكثر فعالية في حث استجابات الأجسام المضادة من مستضدات العصارات الخليوية بينما يمكن تحسين استجابات الخلايا التائيّة السامة عن طريق استهداف المستضدات بغرض انحلال السيتوبلازم والدخول المتتابع إلى مسار معقدات التوافق النسيجي الكبير (بالإنجليزية: MHC) من الصنف الأول. عادة ما يتحقق هذا عن طريق إضافة إشارات شظايا النيتروجين الطرفي لبروتيناليوبيكيتين (بالإنجليزية:ubiquitin).
يمكن أن يؤثر تشكيل البروتين أيضا على استجابة الجسم المضاد، حيث يكون للتركيب "المنظَّم" (مثل الحبيبات القيروسيّة) فعاليّة تفوق تلك غير المنظَّمَة تمتلك سلاسل الجينات المصغرة (أو إبتوبات MHC من الصنف الأول) من مسببات أمراض مختلفة القدرة على إحداث استجابات الخلايا التائية السامة لعدد من مسببات الأمراض خصوصا إذا ما تم تضمين إبتوب (بالإنجليزية:epitope) الخلايا التائيّة المساعدة (بالإنجليزية:TH).
طرق الإيصال
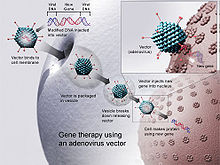
التشابه بين تلقيح الدنا وتقنيات العلاج الجيني
تم إدخال لقاحات الدنا في أنسجة الحيوان بعدد مختلف من الطرق. يستعرض الجدول رقم 2 طرق الإيصال هذه باختصار مع ذكر فوائد ومضار معظم الطرق المستخدمة بإيجاز في الجدول رقم 3. الطريقتان الأكثر شهرة هما حقن الدنـا في محلول ملحي باستخدام إبرة تحت جلدية والأخرى هي المدفع الجيني. يمكن تصفح موقع الأمريكي العلمي للاطلاع على مخطط لبناء لقاح بلازميد الدنا وتسليمه فيما بعد عبر هاتين الطريقتين في جسم المستضيف غالبا ما تعطى حقنة المحلول الملحي عن طريق حقنها في العضل (بالإنجليزية: IM) في العضلات الهيكيلية أو الحقن في الجلد (بالإنجليزية: ID) بحيث يتم إيصال الدنـا للأجواء الخارج الخلوية. بمساعدة التثقيب الكهربائي، يمكن عطب ألياف العضلات مؤقتا بواسطة السموم الفطرية مثل البيوبيفاكين (بالإنجليزية: bupivacaine) أو باستخدام محاليل ملحية مفرطة التوتر أو السكروز. يمكن أن تتأثر الاستجابات المناعية لطريقة الإيصال هذه بعدة عوامل تشمل نوع الإبرة ومحاذاتها وسرعة الحقن وحجم الحقن ونوع العضل والعمر والجنس والحالة الفسيولوجية للحيوان الذي يتم حقنه. الإيصال باستخدام مدفع الجينات وهي الطريقة الأخرى المستخدمة في الإيصال غالبا، تسرّع المقذوفات الدنا البلازميدي (pDNA) الذي يكثَّف في حويصلات الذهب أو التنغستن في الخلايا الهدف باستخدام الهيليوم المضغوط كمسرّع
تضمنت طرق إيصال بديلة تقطير الهباء الجوي للدنا المجرّد على الأسطح المخاطيّة مثل غشاء الأنف والرئة وتضمنت أيضا الإدارة الموضعية للدنا البلازميدي للغشاء المخاطي في العين والمهبل. الإيصال الخاص بالأسطح المخاطية يمكن تحقيقه عن طريق تحضيرات الحويصلات الكاثودية (الموجبة) في الدنا والكرات الميكروية المتحلّلة حيّويا ونواقل عصية الدوسنطاريا(بالإنجليزية: Shigella) والليستريا(بالإنجليزية:Listeria) المضعّفة لإعطاء الدواء عن طريق الفم للغشاء المخاطي المعوي ونواقل فيروس شلل الأطفال المطعمّة.
تحدد طريقة الإيصال جرعة الدنـا اللازمة لتحقيق استجابة مناعية فعالة. تتطلب حُقَنُ المحاليل الملحية مقادير مختلفة من الدنا تتراوح بين 10 مايكرو جرام إلى 1 ميللي جرام في حين يتطلب الإيصال بواسطة المدفع الجيني ما مقداره 100 إلى 1000 مرة أقل من الدنـا من حقن المحلول الملحي في العضل لإثارة استجابة مناعية فاعلة. ويلزم بشكل عام ما بين 2.0 مايكرو جرام إلى 20 مايكرو جرام، مع أنه تمت تسجيل كميات أصغر بحجم 16 نانوجرام. تختلف هذه الكميات من جنس لآخر، حيث يلزم للفئران مثلا دنا أقل بـ 10 مرات من الثدييات. تتطلب حقن المحاليل الملحية دنا أكثر بسبب الحاجة إلى توصيل الدنا إلى الأجواء الخارج الخلوية للنسيج الهدف (وعادة ما تكون العضلات) بحيث يتجاوز العوائق الفيزيائية (مثل الغلالة القاعدية وكميات كبيرة من النسيج الضام على سبيل المثال) قبل أن تتناولها الخلايا بينما يقذف المدفع الجيني بالدنا مباشرة داخل الخلايا مما يتسبب 'بفقدان' أقل.
طريقة أخرى لتلقيح الدنا هي مكتبة التعبير المناعية (بالإنجليزية: ELI). باستخدام هذه التقنية يحتمل أن يتم توصيل كل الجينات من مسببات الأمراض مرة واحدة الأمر الذي قد يكون نافعا لمسببات الأمراض التي يصعب تهذيبها أو تخفيفها. يمكن استخدام ELI لتحديد جينات مسببات الأمراض التي تُحْدِث استجابة وقائية. تم اختبار التقنية على المفطورة الرئوية ومسبب التيفوس الفأري مع جينوم صغير نسبيا ووجد أنه يمكن حتى لمكتبات التعبير الجزئية أن تحدث حماية من الاختبار التالي.
جدول رقم 2: ملخص عن طرق إيصال الدنا البلازميديطريقة الإيصالتركيب الدناالنسيج المستهدفكمية الدنا
الطريق الخلالي أو الزرقي الحقن (إبرة تحت جلدية) محلول مائي في محلول ملحي الإبر العضلية (هيكلية)؛ الإبر داخل الجلد؛ (الإبر الوريدية، الإبر تحت الجلد والحقن داخل الصِّفاق بنجاح متفاوت) كميّات كبيرة (100-200 مايكرو جرام تقريبا)
مدفع الجينات خرزات الذهب المغلفة بالدنا ED (جلد البطن)؛ الغشاء المخاطي المهبلي؛ العضلات التي يمكن إجراء الجراحة عليها وباقي الأعضاء كميّات صغيرة (أقل مقدار 16 نانو جرام)
حقن هوائي (نفّاث) محلول مائي ED عالية جدا (بقدر 300 مايكرو جرام)
التطبيق الموضعي محلول مائي بصرية؛ داخل المهبل كميات صغيرة (تصل حتى 100 مايكرو جرام)
عن طريق السايتوفيكتين الليبوزومات (كاثودية)؛ كرات ميكروية؛ نواقل الفيروس الغدّي المطعّمة؛ ناقل الشيغيللا المضعفة؛ صيغ دهنيات الهباء الجوي الكاثودية IM؛ IV (ليعدي الأنسجة بشكل منظّم)؛ الحقن داخل الصِّفاق؛أغشية الأنف والرئة المخاطيّة؛ التحصين الفموي بواسطة الغشاء المخاطي المعوي متنوّع
جدول رقم 3: منافع ومضار معظم الطرق المستخدمة في توصيل لقاح الدناطرق الإيصالالفائدةالضرر
الحقن في العضل أو داخل الجلد
لا توجد طريقة مخصوصة للإيصال
تعبير دائم أو شبه دائم
ينتشر pDNA بسرعة في جميع أنحاء الجسم
موقع غير فعال للامتصاص بسبب مورفولوجيا نسيج العضلة
استخدام كميات كبيرة نسبيا من الدنا
قد لا تكون استجابة الخلايا التائيّة من النمط الأول هي الاستجابة المطلوبة
المدفع الجيني
يقذف الدنا مباشرة داخل الخلايا
كميات صغيرة من الدنا
قد لا تكون استجابة الخلايا التائيّة من النمط الثاني هي الاستجابة المطلوبة
يتطلب استخدام جسيمات خاملة كناقل
الحقن النفّاث
لا حاجة لاستخدام الجزيئات
يمكن إيصال الدنا إلى خلايا تبعد ملليمترات أو سنتيمترات عن سطح الجلد
قص ملحوظ للدنا بعد طرد عالي الضغط
تعبير أقل بـ 10 أضعاف واستجابة مناعية أقل
يتطلب كميات أعلى من الدنا (تصل إلى 300 مايكرو جرام)
الإيصال عن طريق الليبوزومات
يمكن توليد مستويات عالية من الاستجابة المناعية
يمكن أن يزيد عدوى الدنا البلازميدي الذي يتم إيصاله عن طريق الوريد
مركّبات الدنا الليبوزومية التي توصّل عبر الوريد يمكن أن تعدي جميع الأنسجة فعلا
مركّبات الدنا الليبوزومية التي توصّل عن طريق الأنف يمكن أن تتسبب في تعبير في الغشاء المخاطي القاصي وتوليد الأجسام المضادة IgA
السميّة
عدم فعالية المصل
خطر المرض أو ردات الفعل المناعية
الاستجابة المناعية التي أثارتها لقاحات الحمض النووي
استجابات الخلايا التائيّة المساعدة
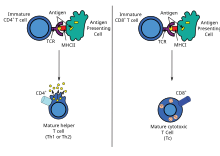
يحفز تقديم المُسْتَضد الخلايا التائيّة لتصبح إما خلايا "سامّة" وتدعى بالخلايا الكابحة CD8+ cells أو خلايا "مساعدة" CD4+ cells. تهاجم الخلايا السامة الخلايا الأخرى التي تحمل جزيئات غريبة أو شاذة على أسطحها.تنظم الخلايا التائيّة المساعدة أوخلايا Th الاستجابات المناعية عن طريق التخاطب مع الخلايا الأخرى. في معظم الحالات، تلحظ الخلايا التائيّة مولد الضد في حال كان محمولا على سطح خلية بواسطة واحدة من معقدات التوافق النسيجي الأساسية (MHC) في الجسم أو جزيئاتها.
يستطيع تحصين الدنـا إثارة مجموعة من استجابات الخلايا التائيّة المساعدة تشمل توالد الليمف وتوليد تشكيلة من سجل (بالإنجليزية: profile) السايتويكنات. هناك فائدة عظمى للقاحات الدنا ألا وهي سهولة التلاعب بها لتوجيه نوع الخلايا التائية المساعدة نحو استجابة من النوع TH1 أو TH2. لكل نوع من هذه الاستجابة أنماط مميزة من تعبير اللمفوكينات والعقديات والتعبير الخاص بأنواع محددة من الجلوبيولين المناعي وأنماط من تهريب الليمفوكينات وأنواع الاستجابات المناعية الفطريّة المولّدة.
إثارة أنماط مختلفة من الخلايا التائيّة المساعدة
يتأثر نوع الخلايا التائيّة المساعدة التي تتم إثارتها بطريقة الإيصال ونوع المستمنع الذي يتم التعبير عنه، كما يتأثر أيضا باستهداف المقصورات الليمفاوية المختلفة. عادة ما تميل إبرة حقن المحلول الملحي (سواء أكانت IM أو ID) لإنتاج استجابات من النوع TH1 بينما يثير الإيصال باستخدام المدفع الجيني استجابات من النوع TH2. ويكون هذا صحيحا في حالة الخلايا والمستضدات البلازمية المرتبطة بالغشاء، ولكن ليس في حالة المستضدات المُفْرِزَة والتي يبدو أنها تنتج استجابات TH2 بغض النظر عن طريقة الإيصال
يكون نوع الخلايا التائية المساعدة التي يتم إثارتها ثابتا عبر الزمن عموما، ولايتغير هذا النوع عند الاختبار أو بعد التحصينات اللاحقة والتي قد تثير عادة النوع المضاد من الاستجابة في الحيوان البدائي. برغم ذلك قام مور (1995) بتحصين وتعزيز الفئران ب (دنـا بلازميدي) يشفّر بروتينات غلاف الحيوان البوغي لمُتَصَوِّرة يولي (بالإنجليزية:Plasmodium yoelii) لملاريا الفأر (بالإنجليزية: PyCSP) ووجد بأن الاستجابة الأولية من النوع TH2 قد تغيرت بعد الحقن لتصبح استجابة من النوع TH1.
الآليّة الأساس لإثارة أنماط مختلفة من الخلايا التائيّة المساعدة
من غير المفهوم بعد كيف يمكن لهذه الأنواع المختلفة من تحصين الدنا أو أنواع المستضدات التي يعبَّر عنها أن تثير سجلات مختلفة للخلايا التائية المساعدة. كان الاعتقاد بأن الكميات الكبيرة نسبيا من الدنا التي تستخدم في حقن IM كانت هي المسؤولة عن حث استجابات TH1. ولكن على أية حال، أثبتت التجارب أن الجرعة لا تحدث اختلافا في نوع TH. لقد تبيّن أن نوع الخلايا التائيّة المساعدة التي يتم إثارتها يتم تحديدها بواسطة حالات متباينة من الخلايا المقدمة (العارضة) للمستضد. يمكن للخلايا التغصنيّة أن تتباين لتكوّن إنترلوكن-12 مفرزا (والذي يدعم تطور خلية TH1) أو إنترلوكن-4 (والذي يدعم استجابات TH2). الدنا البلازميدي الذي يتم حقنه عن طريق الإبرة يلقّم خلويّا في داخل الخلية التغصنيّة التي يتم حفزها بعد ذلك لتتمايز لإنتاج سايتوكين خلايا TH1، بينما يقذف المدفع الجيني الدنا مباشرة داخل الخليّة متجاوزا بذلك تحفيز خلايا TH1.
الاستخدامات العملية للخلايا التائيّة المساعدة المستقطبَة
إن الاستقطاب في الخلايا التائيّة المساعدة مفيد في التأثير على استجابات الحساسية وأمراض المناعة الذاتية. يكون الهدف في أمراض المناعة الذاتية هو تحويل استجابة خلايا TH1 التي تدمر نفسها ذاتيا (مع نشاطها المرتبط بالخلية اللمفاوية التائية السامة للخلايا) إلى استجابة خلايا TH2 غير مدمّرة. تم تطبيق هذه الطريقة بنجاح في تجهيز مرحلة ما قبل المرض الخاصة بنوع مرغوب من الاستجابة في النموذج ما قبل السريري وثبت نجاحه إلى حد ما في تحويل الاستجابة إلى مرض تم إنشاؤه بالفعل.
استجابات الخلية اللمفاوية التائية السامة للخلايا
إحدى فوائد تلقيح الدنا العظمى هي قدرتها على حث الخلايا الليمفاوية التائية السُمّية (CTL) بدون الخطرالمتأصل المرتبط باللقاحات الحيّة. يمكن زيادة استجابات الخلايا الليمفاوية التائية السُمّية ضد إبتوبات (المواقع المستضدية) الخلايا الليمفاوية التائية السُمّية (CTL) السائدة والمتنحيّة مناعيا وكذلك إبتوبات CTL شبه المهيمنة بطريقة تبدو مقلّدة للعدوى الطبيعية. قد تكون هذه وسيلة ناجعة في تقييم ابتوبات الخلايا الليمفاوية التائية السُمّية (CTL) لمستضد ودورها في توفير المناعة.
تميّز الخلايا الليمفاوية التائية السُمّية الببتيدات الصغيرة (8-10 أحماض أمينيّه) المعقدة لـجزيئات معقدات التوافق النسيجي الكبير من الصنف الأول (ريستيفو-1995). تشتق هذه الببتيدات من بروتينات العصارات الخلوية التي يتم تكسيرها وإيصالها إلى جزيئات MHC من الفئة 1 داخلالشبكة الإندوبلازمية (أو ما يعرف بـ ER). استهداف منتجات الجين مباشرة داخل الشبكة الإندوبلازمية (عن طريق إضافة سلسلة الإدخال الأمينيّة الطرفيّة) يجب أن يحسّن من استجابات CTL. تم إثبات ذلك بنجاح بواسطة اللقاحات الفيروسية المطعمة التي تقدّم بروتيناتالإنفلونزا ولكن لا بد من أن ينطبق المبدأ ذاته على لقاحات الدنا أيضا. أظهر استهداف المستضدات بسبب الانحلال الخلوي (وبالتالي الدخول إلى مسار MHC من الفئة الأولى) عن طريق إضافة سلاسل إشارة اليوبيكيتين أو تغيير سلاسل الإشارات الأخرى فعاليته في زيادة استجابات CTL.
يمكن زيادة استجابات CTL عن طريق مشاركة التلقيح مع الجزيئات المساعدة للتنبيه مثل B7-1 أو B7-2 للقاحات الدنا ضد البروتين النووي الخاص بالإنفلونزا أو محفزات إعمار الخلايا المحببة والملتهمة (بالإنجليزية: GM-CSF) للقاحات الدنا ضد نموذج ملاريا الفئران (P. yoelii).[34] تم إثبات مساهمة مشاركة التلقيح مع البلازميدات التي تشفّر الجزيئات المساعدة للتنبيه IL-12 و TCA3 في زيادة نشاط CTL ضد مستضدات البروتين النووي الخاص بفيروس HIV-1والإنفلونزا.
استجابة (الجسم المضاد) الخلطية
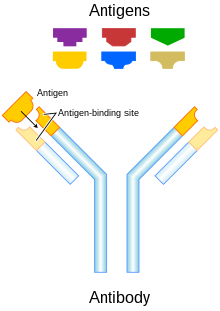
رسم تخطيطي للجسم المضاد والمُسْتَضَدات
استجابات الجسم المضاد التي تستخلصها عمليات تلقيح الدنـا تتأثر بعدد من المتغيرات نذكر بعضها والتي تشمل نوع المستضد الذي تم ترميزه وموقع المستضد المعبَّر عنه (مثال: الخلوية مقابل المفرزة) والعدد وكمية وتكرار عملية التحصين، نوع وطريقة إيصال المستضد على سبيل المثال لا الحصر.
حركيّة استجابة الجسم المضاد
يمكن للاستجابة الخلطية بعد حقنة دنا واحدة أن تكون أطول عمرا بكثير من بعد حقنة واحدة ببروتين مطعم. استجابة الجسم المضاد ضد فيروس التهاب الكبد ب (بالإنجليزية: HBV) مغلف البروتين (بالإنجليزية:HBsAg) تم تعزيزها لمدة تصل لحد 74 أسبوعا بدون مساعدة بينما تم إثبات الحفاظ لمدة أطول على الاستجابة الوقائية لهيماغلوتينين الإنفلونزا في الفئران بعد الإيصال باستخدام مدفع الجينات. تهاجر الخلايا المفرزة للجسم المضاد إلى نخاع العظم والطحال لإنتاج الجسم المضاد على المدى البعيد وعادة ما تتموضع هناك بعد عام واحد.
يمكن تلخيص المقارنات بين الاستجابة المناعية للأجسام المضادة التي تنتجها العدوى الطبيعية (الفيروسية) والتحصين بالبروتين المطعم ووبين التحصين باستخدام الدنا البلازميدي في الجدول رقم 4. تتزايد استجابة الجسم المضاد بواسطة الدنا أبطأ بكثير جدا من حدوث العدوى الطبيعية أو تحصين البروتين المطعّم. يستغرق هذا ما يقارب 12 أسبوعا لوصول ذروة كمية الأجسام المضادة لكل عينة في الفئران برغم أن الحقن يمكن أن يزيد من معدل إنتاج الجسم المضاد. يمكن تفسير هذه الاستجابة البطيئة تبعا لمستويات التعبير المنخفضة للمستضدات التي يتم التعبير عنها خلال أسابيع عديدة مما يعزز المراحل الابتدائية والثانوية من استجابة الجسم المضاد.
جدول رقم 4. مقارنة بين استجابات مولد الضد المعتمدة علي الخلايا التائية المثارة بواسطة تحصين الدنا وتطعيمات البروتين والعدوى الفيروسية طريقة التحصين
لقاح الدناالبروتين المطعمالعدوى الطبيعية
كمية الدنا المنتِج نانو جرام مايكرو جرام ? (نانو جرام- مايكرو جرام)
مدة تقديم الـ Ag عدة أسابيع <أسبوع عدة أسابيع
حركية استجابة Ab ارتفاع بطيء ارتفاع سريع ارتفاع سريع
عدد التطعيمات للحصول على IgG شره وهجرة خلايا ASC إلى نخاع العظم واحد اثنان واحد
أبدال Ab (نماذج الفئران) معتمدة على C’ أو مستقلة عن C’ معتمدة على C’ مستقلة عن C’
إضافة إلى ذلك فإن كمية الأجسام المضادة لكل عينة لأجسام مضادة محددة والتي يثيرها تلقيح الدنا هي أقل من تلك التي يتم الحصول عليها بعد التلقيح بواسطة بروتين مطعم. على أي حال فالأجسام التي ينتجها التحصين تظهر انجذابا كبيرا تجاه الببتيدات الأصلية أكثر من الأجسام المضادة التي تنتج من البروتين المطعّم. بمعنى آخر، فإن تلقيح الدنا ينتج استجابة متفوقة نوعيا. يمكن إنتاج الجسم المضاد بعد تلقيح دنا واحد فقط بينما عادة ما تحتاج تلقيحات البروتين المطعم إلى حقن. كما ذكر سابقا، فإن تحصين الدنا يمكن أن يستخدم لتحييز سجل خلايا TH للاستجابة المناعية وأبدال الجسم المضاد والتي لا يحتمل حدوثها سواء مع العدوى الطبيعية أو تحصين البروتين المطعم. استجابات الجسم المضاد التي يحدثها الدنا مفيدة ليس فقط في التحصين ولكن كوسيلة إعداد أيضا. يمكن إنتاج الأجسام المضادة وحيدة ومتعددة النسيلة لاستخدامها ككواشف على سبيل المثال.
الأساس الميكانيكي لإثارة استجابة الدنـا المناعية
آلية امتصاص الدنـا
عندما تم وصف امتصاص وتعبير الدنا المتتابع لأول مرة في الكائنات الحية في خلايا العضلات؛ كان الاعتقاد بأن هذه الخلايا كانت فريدة في هذه القدرة وذلك بسبب شبكتها المكثفة من أنابيب T. باستخدام المجهر الالكتروني، تم إثبات أن أن امتصاص الدنا يتم تسهيله بواسطة كُهَيْفات(أو ما يسمى بحفر الكلاذرين غير المغلفة).[38] كشفت الأبحاث المتتابعة أن الخلايا الأخرى (مثل نواة خلايا البشرة وخلايا لانغرهانس الليفية و الطلائية) يمكنها استيعاب الدنا أيضا. لم تكن هذه الظاهرة محل موضوعا لكثير من الدراسات ولذا فإن الآلية الفعلية لامتصاص الدنا ما زالت غير معروفة.
هناك نظريتان معروفتان في هذا الصدد، إما أن امتصاص الدنا في الكائنات الحية يحدث بشكل غير محدد بطريقة تشبه البلعمة أو الرشف الخلوي أو عن طريق مستقبلات محددة قد يشمل هذا مستقبل سطح الخلية لبروتين 30kDa أو مستقبلات الخلايا البلعميّة الزبالة. مستقبل سطح الخلية لبروتين 30kDa يرتبط بالتحديد مع شظايا دنا جينومية بضغط دم يساوي 4500 (والتي يتم استيعابها فيما بعد) وتوجد في الخلايا المقدمة للأنتجينAPC وخلايا T المتخصصة. ترتبط مستقبلات الخلايا الملتهمة الزبالة بجزيئات مختلفة تشمل عديدات ريبونوكليوتيدات وبذا فهي عرضة لامتصاص الدنا. امتصاص الدنا عبر المستقبلات يمكن تسهيله بواسطة حضور سلاسل عديد الغوانيلات. ربما يبدو المزيد من البحث في هذا الموضوع عديم الجدوى على اعتبار أن أنظمة الإيصال باستخدام مدفع الجين وتغليف الحويصلات الكاثودية (الموجبة) وطرق التوصيل الأخرى تتجاوز طريقة الإدخال هذه، ولكن قد يكون فهمها مفيدا في تقليص الكلفة (مثال: تقليل الحاجة إلى السايتوفيكتينات) وهو ما يشكل أهمية في صناعة علف الحيوانات.
تقديم المُسْتَضَد بواسطة الخلايا الناشئة في النخاع الشوكي

خلية تغصنية
أظهرت الدراسات التي تستخدم الفئران المعدلة هندسيا في تركيبها (تعرف أيضا بالكمير)؛ أن المستضد يتم تقديمه بواسطة الخلايا التي نشأت في النخاع الشوكي والتي تشمل الخلايا التغصنيّة والخلايا الملتهمة واللمفاويات البائيةالمتخصصة والتي تسمى الخلايا المتخصصة العارضة للمستضد. بعد تطعيم المدفع الجيني في الجلد تهاجر خلايا لانغرهانس إلى العقد الليمفاوية المصرِّفَة لتقدّم المستضد فيها. بعد حقن IM و ID وجد بأن الخلايا التغصنية تقدم أيضا المستضد في العقد الليمفاوية المصرفة فيما وجدت الخلايا المقطعية الملتهمة في الدم المحيطي.
إضافة إلى المقطعية المباشرة للخلايا التغصنية أو الملتهمة، من المعروف أن التَّرَأُس المتقاطع يحدث أيضا بعد IM, ID وإيصال الدنا عن طريق المدفع الجيني. يحصل التَّرَأُس المتقاطع عندما تقدّم الخلايا التي نشأت في النخاع الشوكي ببتيدات من بروتينات تم توليفها في خلية أخرى في سياق MHC من النمط 1. يستطيع هذا تجهيز استجابات الخلايا التائية السميّة ويبدو مهما لتحقيق استجابة مناعية أوليّة كاملة.
دور الموقع المستهدف
يبدأ إيصال الدنا بواسطة IM و ID استجابة مناعية بطرق مختلفة. تقوم نواة خلايا البشرة وخلايا لانغرهانس الليفية والطلائية الموجودة في الجلد بالامتصاص وتقديم المستضد وهي مسؤولة عن حث استجابة أولية للمستضد. خلايا لانغرهانس المَعْدَيَّة تهاجر خارج الجلد (في غضون 12 ساعة) إلى العقد الليمفية المصرّفة حيث تجهز استجابات الليمفيات البائية الثانوية والخلايا التائيّة. في من جهة أخرى فإن خلايا العضلات المخططة في العضلات الهيكليّة عادة ما يتم تعداؤها، ولكن يبدو أنها غير مهمة في تصعيد استجابة مناعية. بدلا من ذلك، فإن الدنا المطعّم بواسطة IM "يغسل" في العقد الليمفاوية المصرّفة خلال دقائق، في حين يتم تعداء الخلايا التغصنيّة الطرفيّة ومن ثم تنشئ هذه الخلايا استجابة مناعية. يبدو أن خلايا العضلة القلبية تعمل كـ"ذخيرة" للمستضد لتهريب خلايا APC المتخصصة.
المحافظة على الاستجابة المناعية
تنتج لقاحات الدنا ذاكرة مناعية فعالة بواسطة عرض معقدات المستضد-الجسم المضاد على خلايا متغصنة جريبية (بالإنجليزية: FDC), والتي هي محفزات ليمفياويات بائية قوية. يمكن تحفيز الخلايا التائية عن طريق خلايا تغصنية جنينية مشابهة. يمكن لـ FDC توليد ذاكرة مناعية بسبب "تداخل" إنتاج الأجسام المضادة مع التعبير طويل المدى للمستضد بحيث تسمح للمعقدات المناعية للمستضد-الجسم المضاد بأن تتشكل وتعرض من خلال FDC.
الإنترفرونات
تتحكم الخلايا التائية السامة والمساعدة بالعدوى الفيروسية عن طريق إفراز مضادات الفيروسات.غالبا ما تفتل الخلايا التائية السامة الخلايا التي أصيبت بالعدوى الفيروسية. على أي حال يمكن حثها لإفراز سايتوكينات مضادة للفيروسات مثل INF-γ و TNF-α والتي لا تقتل الخلية ولكن تضع حدودا صارمة على العدوى الفيروسية عن طريق خفض تنظيم تعبير المكونات الفيروسية. وهكذا يمكن استخدام لقاحات الدنا لكبح الإصابات الفيروسية عن طريق استخدام سيطرة IFN المتوسطة غير المدمرة وتم إثبات ذلك في حالة فيروس الكبد ب. كما أن فيروس IFN-γ هو مهم أيضا في التحكم بعدوى الملاريا، ويجب أخذه بالاعتبار عند تطوير لقاحات الدنا المضادة للملاريا.
تعديل الاستجابة المناعية
تعديل السايتوكينات
لكي يكون اللقاح فعالا يجب أن ينتج استجابة مناعية مناسبة لمسبب مرض محدد وقدرة لقاح الدنا على بلمرة الخلايا التائية المساعدة تجاه سجل TH1 أو TH2 وإنتاج CTL و/أو جسم مضاد عند اللزوم مما يشكل فائدة عظمى في هذا الصدد. يمكن تحقيق ذلك عن طريق تعديل نموذج مولد الضد المعبَّر عنه (مثال: خلوي مقابل مفرز) وطريقة ومسار التوصيل وجرعة الدنـا التي تم إيصالها
على أية حال، فيمكن تحقيق ذلك عن طريق مشاركة الإشراف على الدنا البلازميدي الذي يشفّر جزيئات المناعة التنظيمية مثل السايتكونات والليمفونيكات أو الجزيئات المساعدة للتنبيه. يمكن إدارة هذه "المواد الجينية المساعدة" بعدة طرق:
كخليط من بلازميدين منفصلين، أحدهما يشفّر الـمستمنع فيما الآخر يشفّر السايتوكين.
كناقل وحيد ثنائي أو متعدد السيسترونات مفصول بمناطق فاصلة أو
ككمير مشفر البلازما أو بروتين التحام.
عموما فإن العوامل الالتهابية المساعدة للإشراف (مثل الإنترلوكينات وعامل النخر الورمي ومحفزات إعمار الخلايا المحببة والملتهمة (GM-CSF)(بالإضافة إلى الايتوكينات المنتجة لخلايا TH2 ترفع من استجابات مضادات الأجسام فيما تقوم العوامل الالتهابية والسايتوكينات المنتجة لخلايا TH1 بخفض الاستجابة الخلطية وزيادة استجابات السايتوكينات (وهي الأكثر أهمية في حالة الحماية من الفيروسات على سبيل المثال). تستخدم الجزيئات المساعدة للتنبيه مثل B7-1 و B7-2 و CD40L في بعض الأحيان أيضا.
تم تطبيق هذا المبدأ بنجاح في الإدارة الموضوعية لترميز لدنا البلازميدي IL-10. البلازميد المشفر B7-1 (دواء على APCs) حسّن بنجاح الاستجابة المناعية في نماذج مضادات الورم ومزج البلازميدات المشفرة لـ GM-CSF وبروتينات غلاف الحيوان البوغي لـ P.
قام yoelii (PyCSP) بتحسين الحماية ضد التحديات المتعاقبة (في حين فشل PyCSP المشفر بلازميديا في ذلك). اقترح أنه ربما يتسبب GM-CSF في تقديم الخلايا التغصنية للمستضد بشكل أكثر فعالية ويحسن من إنتاج IL-2 وتفعيل خلية TH مما يؤدي بالتالي إلى تحريك الاستجابة المناعية المتزايدة. يمكن تحسين هذا أكثر بواسطة العامل الأولي باستخدام مزيج من pPyCSP و pGM-CSFوالحقن لاحقا بفيروسات جدرية مطعمة تعبر عن PyCSP على أي حال فالمشاركة بحقن البلازميدات التي ترمز GM-CSF (أو IFN-γ أو IL-2) والتحام البروتين من P. بروتين سطح الميروزويت شابودي رقم 1 (النهاية الكربونية) وسطح فيروس بروتين التهاب الكبد ب (PcMSP1-HBs) يلغي فعليا الحماية ضد التحدي مقارنة بالحماية المكتسبة عن طريق إيصال pPcMSP1-HBs لوحدهـا.
فوائد استخدام المواد المساعدة هي كلفتها المنخفضة وبساطة إدارتها وتجنب السايتكوينات المطعمة غير المستقرة والتي يحتمل أن تكون سامة، العوامل المساعدة "الاصطلاحيّة" (مثل الشب وفوسفات الكالسيوم والدهن أحادي الفسفور A وتوكسين الكوليرا والحويصلات الكاثودية (الموجبة) وحويصلات مان-المغلّفة و QS21 وكاربوكسي مثيل سللوز الكالسيوم (carboxymethylcellulose) وأوبينيميكس(ubenimix)). ومع ذلك فإن السميّة المحتملة لتعبير السايتوكين الممتد لم يتم تأكيدها في أنواع حيوانية عديدة ومهمة تجاريا فما زالت الجينات السايتوكينية بحاجة إلى أن يتم تعريفها وعزلها. إضافة إلى ذلك، فإن السايتوكنات المشفرة البلازميد المتعددة تعدل نظام المناعة بطرق مختلفة تبعا لوقت الإيصال. مثلا، بعض سايتكونات الدنا البلازميدي يتم إيصالها على النحو الأمثل بعد توليد مستمنع الدنا البلازميدي وذلك لأن الإيصال السابق أو مشاركة الإيصال من الممكن فعليا أن تخفض من استجابة معينة وتزيد من استجابات غير محددة
لَبِنات CpG لتنشيط المناعة
يبدو أن الدنا البلازميدي بحد ذاته له تأثير مساعد على نظام المناعة؛ حيث وجد أن الدنا المشتق على نحو بكتيري يحرك آليات الدفاع المناعي وتنشيط الخلايا التغصنية وإنتاج سايتوكينات خلايا TH1. ويحدث هذا بسبب ملاحظة سلاسل ثنائي النوكليوتيد CpG معينة والتي تحفز المناعة.
تتكرر متواليات CpG التنشيطية (تعرف بـ CpG-S) أكثر بعشرين مرة في الدنا المشتق على نحو بكتيري من حقيقيات النواة. وذلك لأن حقيقات النواة تعرض "إخماد CpG"-مثال: أزواج ثنائي النوكليوتيد تحدث أقل بكثير من المتوقع. زيادة على ذلك، فإن سلاسل CpG-S هي تحت مثـْيَلة hypomethylated . عادة ما يحدث هذا في الدنا البكتيري بينما لبناتCpG التي تحدث في حقيقيات النواة هي مميثلة جميعها في نيوكليوتيدات السيتوزين. على العكس من ذلك، سلاسل النيوكليوتيدات التي تمنع تنشيط الاستجابة المناعية (تدعى بالـ CpGالمعادلة أو CpG-N) يتم تمثيلها أكثر في الجينومات حقيقية النواة. وجد أن سلسلة تحفيز المناعة المثالية هي عبارة عن ثنائي نوكليوتيد CpG غير مميثلة محاطة ب اثنين من بيورينات 5’ واثنين من البيرميدينات رقم 3’. كما أن المناطق المرافقة خارج سداسي تحفيز المناعة هذا ليكون غنيا بالجوانين لتأكيد الربط والامتصاص في الخلايا الهدف.
يعمل النظام الفطري بالتآزر مع النظام المناعي المساعد لجبل استجابة ضد بروتين الدنا المشفر. تنتج سلاسل CpG-S تنشيطا لخلايا (ب) متعددة النسيلة وتنظيم تعبير السايتوكونات وإفرازها.[55] تفرز الخلايا الملتهمة المحفزة IL-12, IL-18, TNF-α, IFN-α, IFN- و IFN-γ بينما تفرز خلايا (ب) المحفزة IL-6 وبعض IL-12. يمكن أن يضمن التلاعب بسلاسل CpG-S وسلاسل CpG-N في العمود الفقري البلازميدي للقاح الدنا نجاح الاستجابة المناعية للمستضد المناعي ويقود الاستجابة المناعية تجاه النمط الظاهري لخلايا TH1. يصبح هذا مفيدا إذا احتاج مسبب المرض استجابة لخلايا TH بغرض الوقاية. استخدمت سلاسل CpG-S أيضا كمساعدات خارجية لكل من الدنا وتلقيح البروتين المطعم بمعدلات نجاح متفاوتة. كائنات حية أخرى بلبنات CpG ممـثـْيَلة أظهرت أيضا توسع تعبير خلايا ب متعددة النسيلة. على أي حال فإن الآلية وراء هذا قد تكون أكثر تعقيدا من مثـْيَلة -تحت مثـْيَلة لدنا الفئران لم يثبت جبلها لاستجابة مناعية.
معظم الأدلة على وجود سلاسل CpG المحفزة مناعيا تأتي من دراسات مسبب التيفوس الفأري. من الواضح أن استقراء هذه المعطيات على أنواع أخرى يجب أن يتم بحذر فالأنواع المختلفة قد يلزمها سلاسل مرافقة أخرى كالربط مع خصوصيات مستقبلات الخلايا الزبالة التي تختلف من نوع لآخر. زيادة إلى ذلك فأنواع مثل الحيوانات المجترة قد تكون غير حساسة لسلاسل التحفيز المناعي تبعا لعبء الجهاز الهضمي الكبير الذي تبديه. قد تكون مزيد من الدراسات مفيدة في تحسين تلقيح الدنا خصوصا في صناعة أغذية الحيوانات.
الدعائم البديلة
يمكن تعزيز الاستجابة المناعية للدنا المرأس عن طريق الإشراف على البروتين المطعم أو فيروسات الجدري المطعّمة. استراتيجيات "تعزيز-الرئيس" مع البروتين المطعم نجحت بزيادة كل من معادلة الجسم المضاد (titre) وجشع الجسم المضاد وثباته للمستمنعات الضعيفة مثل البروتين المغلف لفيروس HIV-1. تم إثبات أن زيادات الفيروس المطعم فعالة جدا في تعزيز استجابات خلايا CTL للدنا المرأس. يركز الترأيس باستخدام الدنا الاستجابة المناعية على المستمنع المطلوب، بينما التعزيز بالفيروس المطعم يعطي كمية أكبر من المستضد المعبر عنه مما يؤدي لزيادة كبيرة في استجابات مخصوصة لخلايا CTL.
استراتيجيات تنشيط الترأس كانت ناجحة في إنتاج الوقاية ضد تحدي الملاريا في عدد من الدراسات. الفئران المرأسة التي تحوي دنا بلازميديا يشفر سطح غلاف البروتين الحيوان البوغي المتصورة (بلازميدية) لـ yoelii(PyCSP), ومن ثم تنشط بلقاح فيروسي مطعم يعبر عن نفس البروتين ويحوي مستويات أعلى من الجسم المضاد بصورة ملحوظة. نشاط الـ CTL و IFN-γ ومن ثم مستويات أعلى من الحماية من تلك التي تم تحصينها وتنشيطها عن طريق الدنا البلازميدي لوحده. يمكن تحسين ذلك أكثر عن طريق الترأس بخليط من البلازميدات المشفرة PyCSP والتيفوس الفأري قبل التنشيط بفيروس اللقاح المطعم. تم إثبات استراتيجية تنشيط ترأس فعالة لنموذج P. knowlesi للملاريا القردية. تم رأس قرود الربص بلقاح دنا متعدد المركبات والمستويات يرمّز مستضدات مرحلة الكبد الثانية وبروتين سطح غلاف الحيوان البوغي (PkCSP) وبروتين سطح الحيوان البوغي رقم 2 (PkSSP2) واثنين من مستضدات مرحلة الدم وبروتين سطح المتصوّرة القميّة رقم 1 (PkMSP1p42). تم تعزيزها فيما بعد بفيروس جدري الكناريا المطعم مرمزا كل المستضدات الأربعة (ALVAC-4. طورت القرود المطعمّة مستضدات ضد الحيوانات البوغية والكريات الحمراء المصابة واستجابة الخلايا التائية المفرزة من نوع IFN-γ ضد بيبتيدات من PkCSP. تم تحقيق الحماية الجزئية ضد اختبار الحيوان البوغي وتم تقليل متوسط التسمم الدموي الطفيلي بشكل ملحوظ مقارنة بالتحكم بالقرود. بينما لا تكون هذه النماذج مثالية في حالة استقراء البلازميد المنجلي في حالة الإنسان إلا أنها مهمة في الاختبارات ما قبل السريرية.
طرق إضافية لتحسين استجابات الدنـا المناعية
تركيبات من الحمض النووي
يمكن تحسين فعالية مناعة الدنا عن طريق تثبيت الدنا ضد التحلل الحيوي وزيادة فعالية إيصال الدنا إلى خلايا تقديم المُسْتَضَد. تم إثبات هذا عن طريق تغليف الحويصلات الكاثودية القابلة للتحلل (مثل متعدد (lactide-co-glycolide) موضوعة مع بروميد سيتيل ثلاثي ميثيل الأمونيوم بالإنجليزية cetyltrimethylammonium bromide) مع الدنا. مثل حويصلات الدنا المغلفة هذه يمكن أن تكون فاعلة في رفع استجابة CTL كفيروسات الوقس المطعمة خصوصا عند خلطها مع الشّب؛ ويبدو أن الجسيمات التي يبلغ قطرها 300 نانو مترا هي الأكثر فعاليّة للامتصاص بواسطة الخلايا العارضة (المقدِّمة) للمُسْتَضَد.
نواقل الفيروسات الألفاويّة
استخدمت نواقل الناشئة عن فيروسات ألفا المعاد صياغتها وراثيا لتحسين فعالية تلقيح الدنـا يتم إدخال ترميز جين المستضد ذي العلاقة إلى ناسخ فيروسات ألفا بحيث تستبدل الجينات التركيبية فيما تترك الجينات المكرّرة وغير التركيبية دون أن تمس. استخدم كل من فيروس سن دبس وفيروس غابة سيمليكي لبناء ناسخات فيروسات ألفا المعاد صياغتها وراثيا.
بعكس لقاحات الدنا التقليدية، فإن نواقل فيروسات ألفا تقتل الخلايا المَعْدَيَّة وتقدّم بشكل عابر فقط. كما أن جينات فيروسات ألفا المكررة يعبر عنها إضافة إلى إدخال اللقاح. ومع أنه ليس من الواضح الكيفية التي تثير فيها مكرِّرات فيروسات ألفا الاستجابة المناعية، إلا أنه يعتقد أن هذا قد يكون بسبب مستويات تعبير البروتين العالية من خلال هذا الناقل، تؤدي استجابات السايتوكين المستحث عن طريق المكرّر أو موت الخلايا المبرمج والمستَحَث عن طريق المكرر إلى امتصاص محسّن لمولد الضد عن طريق الخلايا التغصنيّة.
انظر أيضا
ناقل (علم الأحياء الجزيئية)
لقاح الإيدز
استخدام التقانة الحيوية في تصنيع الأدوية
-----------------------
ليست هناك تعليقات:
إرسال تعليق